- Glucosa-6-fosfatasa
-
Glucosa-6-fosfatasa alfa Otros nombres Glucosa-6-fosfatasa subunidad catalítica HUGO 4056 Símbolo G6Pase-α Datos genéticos Código de gen G6PC Tipo de gen Gen Codificante Locus Cr. 17 q21 Estructura/Función proteica Tamaño 357 (aminoácidos) Bases de datos Número EC 3.1.3.9 Entrez 2538 OMIM 613742 RefSeq NM_000151 UniProt P35575 Glucosa-6-fosfatasa 2 HUGO 28906 Símbolo G6PC2 Datos genéticos Código de gen G6PC2 Tipo de gen Gen Codificante Locus Cr. 2 q24-q31 Estructura/Función proteica Tamaño 355 (aminoácidos) Bases de datos Número EC 3.1.3.9 Entrez 57818 OMIM 608058 RefSeq NM_001081686 UniProt Q9NQR9 Glucosa-6-fosfatasa beta Otros nombres Glucosa-6-fosfatasa 3 HUGO 28906 Símbolo G6Pase-β Datos genéticos Código de gen G6PC3 Tipo de gen Gen Codificante Locus Cr. 17 q21.31 Estructura/Función proteica Tamaño 346 (aminoácidos) Bases de datos Número EC 3.1.3.9 Entrez 92579 OMIM 611045 RefSeq NM_138387 UniProt Q9BUM1 La glucosa-6-fosfatasa (G6Pase) (EC 3.1.3.9) es una enzima que cataliza la hidrólisis de la glucosa-6-fosfato dando como resultado glucosa y un grupo fosfato.
- D-glucosa-6-fosfato + H2O
 D-glucosa + fosfato
D-glucosa + fosfato
Una vez producida la glucosa, ésta es exportada fuera de la célula a través de las proteínas transportadoras de glucosa. La catálisis producida por esta enzima es la etapa final de la gluconeogénesis y de la glucogenolisis, y por tanto, juega un papel fundamental en la regulación homeostática de los niveles de glucosa en la sangre. En los humanos hay tres genes que codifican esta enzima: G6PC, G6PC2 y G6PC3.
La familia de la glucosa-6-fosfatasa incluye dos fosfohidrolasas funcionales: G6Pase-α (del gen G6PC) y G6Pase-β (del gen G6PC3). La primera de ellas es el prototipo. G6Pase-α y G6Pase-β comparten estructura similar del sitio activo, topología, mecanismo de acción y propiedades cinéticas con respecto a la hidrólisis de la glucosa-6-fosfato.
Contenido
Estructura y función
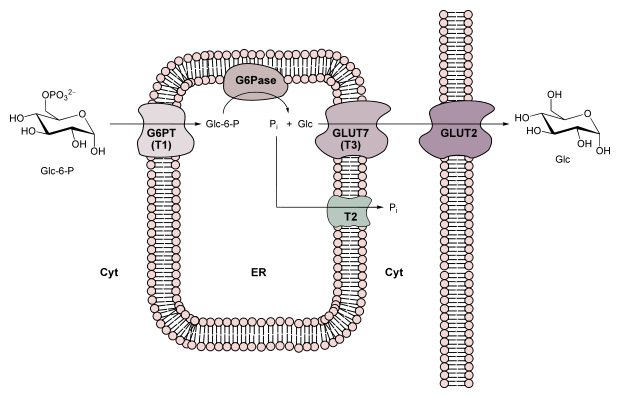
Aunque no se ha llegado a un consenso, un gran número de científicos se adhieren a la opinión de que para explicar las propiedades catalíticas de la glucosa-6-fosfatasa, ésta utiliza un modelo de transporte de sustrato. En este modelo, la G6Pase tiene un bajo nivel de selectividad. La transferencia de la glucosa-6-fosfato al retículo endoplasmático es llevada a cabo por una proteína transportadora (T1). El retículo endoplasmático contiene adicionalmente estructuras que permiten la salida del grupo fosfato (T2) y de la glucosa (T3).
Se ha propuesto que la hidrólisis de la glucosa-6-fosfato se realiza mediante un intermedio covalente fosfohistidina-glucosa-6-fosfato. El sitio activo de la G6Pase-α se identificó inicialmente por la presencia de un motivo encontrado en las lípido fosfatasas, ácido fosfatasas y vanadio haloperoxidasas.
Los residuos esenciales en el sitio activo de las vanadio haloperoxidasas incluyen: Lys-353, Arg-360, Arg-490, His-404 y His-496. Los residuos correspondientes en el sitio activo de la G6Pase incluyen:
- Arg-170 y Arg-83, que donan los iones hidrógeno al fosfato, estabilizando el estado de transición.
- His-119, que proporciona un protón al oxígeno defosforilado de la glucosa.
- His-176, que completa el ataque nucleofílico al fosfato para formar un enlace covalente al intermedio enzima fosforilada.
En la cloruro peroxidasa que contiene vanadio, se encontró que la Lys-353 estabiliza el fosfato en el estado de transición. De todas formas, el correspondiente residuo en la G6Pase (Lys-76) se situa en la membrana del retículo endoplasmático y su función, si la tiene, todavía se desconoce. Con la excepción de Lys-76, todos estos residuos citados anteriormente están localizados en el lado luminal de la membrana del retículo endoplasmático.
La G6Pase-β es una proteína de membrana de 346 aminoácidos que comparte el 36% de la secuencia con la G6Pase-α. En la G6Pase-β su sitio activo contiene His-167, His-114 y Arg-79. De forma similar al sitio activo de la G6Pase-α, la His-167 es el residuo que proporciona el ataque nucleofílico y el His-114 y Arg-79 son los donantes de hidrógeno. La G6Pase-β está también localizada en la membrana del reticulo endoplasmático, aunque se desconoce su orientación.
Mecanismo
- La hidrólisis de la glucosa-6-fosfato empieza con el ataque nucleofílico al fosfato unido a la glucosa por la His-176 resultando la formación de un enlace fosfohistidina y la degradación de un carbonilo.
- Un oxígeno negativamente cargado transfiere sus electrones reformando un carbonilo y rompiendo su enlace con la glucosa.
- El fosfo-intermedio producido por la reacción entre la His-176 y el grupo fosfato se rompe por un ataque nucleofílico.
- Después de la adición de otro grupo hidróxido y la descomposición de un carbonilo, el carbonilo es reformando expulsando los electrones originalmente donados por el residuo His-176 creando un grupo fosfato libre y completando la hidrólisis.
Expresión
Los genes que codifican la enzima se expresan principalmente en el hígado, en la corteza renal, en las células beta del páncreas y en la mucosa intestinal (especialmente en periodos de ayuno).
La glucosa-6-fosfatasa se presenta en una gran variedad de músculos en el reino animal, si bien es cierto, en muy bajas concentraciones. El glicógeno que el músculo almacena no está disponible para el resto de células del cuerpo ya que la glucosa-6-fosfato no puede cruzar el sarcolema a menos que sea desfosforilada. La enzima juega un papel importante durante los periodos de ayuno y cuando los niveles de glucosa están bajos. Se ha observado que el ayuno y la diabetes multiplica entre 2 y 3 veces la actividad de la G6Pase en el hígado. La actividad de la G6Pase también se incrementa dramáticamente en el nacimiento cuando el organismo ya es independiente de las fuentes de glucosa maternas. El gen humano de la G6Pase contiene 5 exones con una longitud aproximada de 125,5 kb y está localizado en el cromosoma 17q21.
Relevancia clínica
Las mutaciones en la glucosa-6-fosfatasa alfa pueden provocar la enfermedad de Von Gierke, que se caracteriza por la pérdida de la homeostasis de la glucosa en la sangre y por desórdenes en el metabolismo de los lípidos y del glicógeno.
Enlaces externos
Categorías:- Genes del cromosoma 17
- Genes del cromosoma 2
- Hidrolasas
- D-glucosa-6-fosfato + H2O
Wikimedia foundation. 2010.