- Cadena de transporte de electrones
-
La cadena de transporte de electrones es una serie de transportadores de electrones que se encuentran en la membrana plasmática de bacterias, en la membrana interna mitocondrial o en las membranas tilacoidales, que mediante reacciones bioquímicas que producen adenosin trifosfato (ATP), que es el compuesto energético que utilizan los seres vivos. Sólo dos fuentes de energía son utilizadas por los organismos vivos: reacciones de óxido-reducción (redox) y la luz solar (fotosíntesis). Los organismos que utilizan las reacciones redox para producir ATP se les conoce con el nombre de quimioautótrofos, mientras que los que utilizan la luz solar para tal evento se les conoce por el nombre de fotoautótrofos. Ambos tipos de organismos utilizan sus cadenas de transporte de electrones para convertir la energía en ATP.
Contenido
Conceptos generales
La misión de la cadena transportadora de electrones es la de crear un gradiente electroquímico que se utiliza para la síntesis de ATP. Dicho gradiente electroquímico se consigue mediante el flujo de electrones entre diversas sustancias de esta cadena que favorecen en último caso la translocación de protones que generan el gradiente anteriormente mencionado. De esta forma podemos deducir la existencia de tres procesos totalmente dependientes:
- Un flujo de electrones desde sustancias individuales.
- Un uso de la energía desprendida de ese flujo de electrones que se utiliza para la translocación de protones en contra de gradiente, por lo que energéticamente estamos hablando de un proceso desfavorable.
- Un uso de ese gradiente electroquímico para la formación de ATP mediante un proceso favorable desde un punto de vista energético.
Antecedentes
Las reacciones redox son reacciones químicas en las cuales los electrones son transferidos desde una molécula donadora hacia una molécula aceptora. La fuerza que conduce a esta clase de reacciones es la energía libre de Gibbs de los reactivos y los productos. La energía libre de Gibbs es la energía disponible para realizar un trabajo. Ninguna reacción que incremente la energía libre de Gibbs total de un sistema se realizará de forma espontánea. La transferencia de electrones desde moléculas altamente energéticas (donadoras) hacia moléculas de bajo poder energético (aceptoras) puede ser espaciado en una serie de reacciones redox intermediarias, que en definitiva forman una cadena de transporte. El hecho de que estas reacciones sean termodinámicamente posibles no significa que puedan ocurrir; por ejemplo una mezcla de hidrógeno y oxígeno no entra en ignición de forma espontánea, se requiere suplementar cierta energía de activación o bajar la energía de activación de la reacción. Los sistemas biológicos usan estructuras complejas que reducen la energía de activación de las reacciones bioquímicas. El transporte de electrones se realiza mediante reacciones que son termodinámicamente favorables, y han sido acopladas a reacciones que termodinámicamente no lo son, como por ejemplo son la separación de carga o la creación de un gradiente osmótico. De esta forma la energía libre del sistema baja y hace posible que el proceso se lleve acabo. Las macromoléculas biológicas que catalizan este tipo de reacciones desfavorables, termodinámicamente hablando, se han encontrado en todas las formas de vida conocidas, y sólo realizan estas funciones sí y solo sí están acopladas a reacciones termodinámicas favorables y que ocurran a la vez de las que no lo son. La cadena de transporte de electrones produce energía para la formación de un gradiente electroquímico, es decir se utiliza ese flujo para el transporte de sustancias a través de membrana. Este gradiente se utiliza para realizar, posteriormente un trabajo mecánico, como puede ser la rotación de un flagelo bacteriano o la síntesis de ATP, que es imprescindible para un organismo. El ATP también se puede obtener de otras formas como por ejemplo en la fosforilación a nivel de sustrato. Existen organismos que obtienen el ATP exclusivamente mediante fermentación, pero en la mayoría de los casos la generación de grandes cantidades de ATP se realiza a través de cadenas de transportes de electrones.
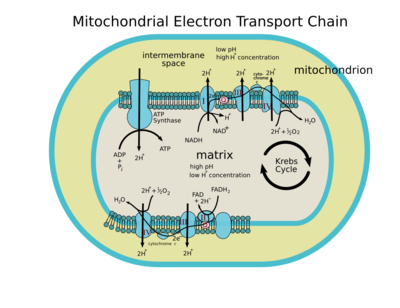
Cadenas de transporte de electrones en mitocondrias
Las células de todos los eucariotas contienen orgánulos intracelulares conocidos con el nombre de mitocondrias que producen ATP. Las fuentes de energía como la glucosa son inicialmente metabolizados en el citoplasma y los productos obtenidos son llevados al interior de la mitocondria donde se continua el catabolismo usando rutas metabólicas que incluyen el ciclo de los ácidos tricarboxílicos, la beta oxidación de los ácidos grasos y la oxidación de los aminoácidos. El resultado final de estas rutas es la producción de dos donadores de electrones: NADH y FADH2. Los electrones de estos dos donadores son pasados a través de la cadena de electrones hasta el oxígeno, el cual se reduce para formar agua. Esto es un proceso de múltiples pasos que ocurren en la membrana mitocondrial interna. Las enzimas que catalizan estas reacciones tienen la notable capacidad de crear simultáneamente un gradiente de protones a través de la membrana, produciendo un estado altamente energético con el potencial de generar trabajo. Mientras el transporte de electrones ocurre con una alta eficiencia, un pequeño porcentaje de electrones son prematuramente extraídos del oxígeno, resultando en la formación de un radical libre tóxico: el superóxido. En los últimos años se ha descubierto que los complejos de la cadena de transporte de electrones suelen juntarse unas con otras formando estructuras proteínicas mayores que se nombran supercomplejos respiratorios. Estos supercomplejos suelen estar formados únicamente por los complejos I, III y IV en plantas, mientras que en mamíferos se les han encontrado en conjunto con complejo II también. Se ha propuesto que la función de la formación de los supercomplejos respiratorios es la canalización de los electrones a través de los complejos I, III y IV, con la finalidad de agilizar el transporte de electrones, regular la formación de radicales de oxígeno o incrementar la eficiencia de producción de ATP por medio de la exclusión de la alternativa oxidasa o de las NAD(P)H dehidrogenasas del tipo II del transporte de electrones. De esta forma únicamente las proteínas que tienen la capacidad de transportar protones a través de la membrana interna de las mitochondrias y que por lo mismo contribuyen a la formación del gradiente electroquímico para la producción de ATP estarían incluídas en la estructura de los supercomplejos. El parecido entre las mitocondrias intracelulares y las bacterias de vida libre es altísimo. El conocimiento de la estructura, la funcionalidad y las similitudes en el ADN entre mitocondrias y las bacterias prueban fuertemente el origen endosimbióntico de las mitocondrias. Es decir, hay fuertes pruebas que indican que las células eucarióticas primitivas incorporaron bacterias, que debido a las fuerzas selectivas de la evolución se han trasformado en un orgánulo de éstas.
Transportadores redox mitocondriales
Representación minimalista de la cadena de transportadora de electrones (CTE). La energía obtenida a través de la transferencia de electrones (flechas negras) a lo largo de la CTE es usada para bombear protones (flechas rojas) desde la matriz mitocondrial al espacio intermembrana, creando un gradiente electroquímico de protones a través de la membrana mitocondrial interna denominado ΔΨ. Este gradiente electroquímico de protones permite a la ATP sintasa utilizar el flujo de H+ que se genera a través de esta enzima para generar ATP a partir de adenosina difosfato (ADP) y fosfato inorgánico.
Se han identificado cuatro complejos enzimáticos unidos a membrana interna mitocondrial. Tres de ellos son complejos transmembrana, que están embebidos en la membrana interna, mientras que el otro esta asociado a membrana. Los tres complejos transmembrana tienen la capacidad de actuar como bombas de protones. El flujo de electrones global se esquematiza de la siguiente forma:
NADH → Complejo I → Q → Complejo III → Citocromo c → Complejo IV → H2O ↑ Complejo IIComplejo I
El "complejo I" o NADH deshidrogenasa o NADH:ubiquinona oxidoreductasa (EC 1.6.5.3) capta dos electrones del NADH y los transfiere a un transportador liposoluble denominado ubiquinona (Q). El producto reducido, que se conoce con el nombre de ubiquinol (QH2) puede difundir libremente por la membrana. Al mismo tiempo el Complejo I transloca cuatro protones a través de membrana, produciendo un gradiente de protones.
El flujo de electrones ocurre de la siguiente forma:
El NADH es oxidado a NAD+, reduciendo al FMN a FMNH2 en un único paso que implica a dos electrones. El siguiente transportador de electrones es un centro Fe-S que sólo puede aceptar un electrón y trasferirlo a la ubiquinona generando una forma reducida denominada semiquinona. Esta semiquinona vuelve a ser reducido con el otro electrón que quedaba generando el ubiquinol, QH2. Durante este proceso, cuatro protones son translocados a través de la membrana interna mitocondrial, desde la matriz hacia el espacio intermembrana.
Complejo II
El "Complejo II" o Succinato deshidrogenasa; [1] EC 1.3.5.1 no es un bomba de protones. Además es la única enzima del ciclo de Krebs asociado a membrana. Este complejo dona electrones a la ubiquinona desde el succinato y los transfiere vía FAD a la ubiquinona.
Complejo III
El "complejo III" o EC 1.10.2.2, obtiene dos electrones desde QH2 y se los transfiere a dos moléculas de citocromo c, que es un transportador de electrones hidrosoluble que se encuentra en el espacio intermembrana de la mitocondria. Al mismo tiempo, transloca dos protones a través de la membrana por los dos electrones transportados desde el ubiquinol.
Complejo IV
El complejo IV o Citocromo c oxidasa; EC 1.9.3.1 capta cuatro electrones de las cuatro moléculas de citocromo c y se transfieren al oxígeno (O2), para producir dos moléculas de agua (H2O). Al mismo tiempo se translocan cuatro protones al espacio intermembrana, por los cuatro electrones. Además "desaparecen" de la matriz 4 protones que forman parte del H2O.
Acoplamiento con la fosforilización oxidativa
La hipótesis del acoplamiento quimiosmótico, lo que el valió el premio Nobel de química a Peter D. Mitchell, explica que la cadena de transporte de electrones y la fosforilación oxidativa están acopladas por el gradiente de protones. El flujo de protones crea un gradiente de pH y un gradiente electroquímico. Este gradiente de protones es usado por la ATP sintasa para formar ATP vía la fosforilación oxidativa. La ATP sintasa actúa como un canal de iones que "devuelve" los protones a la matriz mitocondrial. Durante esta vuelta, la energía libre de Gibbs producida durante la generación de las formas oxidadas de los transportadores de electrones es liberada. Esta energía es utilizada por la síntesis de ATP, catalizada por el componente F1 del complejo FOF1 ATP sintasa
El acoplamiento con la fosforilación oxidativa es un paso clave en la producción de ATP. Sin embargo, en ciertas ocasiones desacoplarlo puede tener usos biológicos. En la membrana interna mitocondrial de los tejidos adiposos marrones existe una gran cantidad de termogenina, que es una proteína desacopladora, que actúa como una vía alternativa para el regreso de los protones a la matriz. Esto resulta en consumo de la energía en termogénesis en vez de utilizarse para la producción de ATP. Esto puede ser útil para generar calor cuando sea necesario, por ejemplo en invierno o durante la hibernación de ciertos animales.
También se conocen desacoplantes sintéticos como el caso del 2,4-dinitrofenol, que se ha usado como pesticida, debido a su alta toxicidad.
Resumen
La cadena de transporte de electrones mitocondrial utiliza electrones desde un donador ya sea NADH o FADH 2 y los pasa a un aceptor de electrones final, como el O2, mediante una serie de reacciones redox. Estas reacciones están acopladas a la creación de un gradiente de protones generado por los complejos I, III y IV. Dicho gradiente es utilizado para generar ATP mediante la ATP sintasa.
Las reacciones catalizadas por los complejos I y III están en equilibrio. Las concentraciones de reactivos y productos son aproximadamente los mismos. Esto significa que estas reacciones son reversibles al incrementar la concentración de producto.
Cadena transportadora de electrones en bacterias
En eucariotas, el NADH es el donador de electrones más importante. En procariotas, es decir bacterias y arqueas la situación es algo más complicada, debido a que hay un gran número de donante de electrones y un gran número de aceptores. Si generalizamos el transporte en bacterias este podría quedar de la siguiente forma:
Donador Donador Donador ↓ ↓ Aceptor AceptorPuede que los electrones pueden entrar a la cadena en tres niveles: un nivel en donde participa una deshidrogenasa, otro en la que actúa un reservorio de quinonas, o en un nivel en el que actúa un transportador móvil como es el citocromo. Estos niveles corresponden a sucesivos potenciales redox más positivos o sucesivas bajadas de las diferencias en el potencial relativo en los aceptores de electrones. En otras palabras, corresponden a cambios cada vez menores en la energía libre de Gibbs.
Las bacterias pueden usar múltiples cadenas de transporte de electrones, e incluso simultáneamente. Las bacterias pueden usar varios donadores diferentes de electrones. Por ejemplo, Escherichia coli, cuando crece en condiciones aeróbicas usando glucosa como fuente de energía, usa dos NADH deshidrogenasas diferentes y dos quinol oxidasas diferentes, un total de cuatro cadenas de transporte que funcionan simultáneamente.
Las bacterias también generan un gradiente de protones, para ello utilizan al menos tres bombas de protones, al igual que las mitocondrias, aunque se han descrito casos en los que solo existen dos o incluso una. Evidentemente siempre tiene que existir al menos una bomba de protones para poder generar el gradiente electroquímico, que es esencial para la generación de ATP.
Donadores de electrones
En la biosfera actual, los donadores de electrones más comunes son las moléculas orgánicas. Los organismos que usan moléculas orgánicas como fuente de energía son conocidos como organotrofos. Sin embargo, existen procariotas que son capaces de utilizar fuentes inorgánicas como fuente de energía y se les conoce por ello con el nombre de litotrofos. Estos donadores inorgánicos incluyen al hidrógeno, al monóxido de carbono, el amonio, el nitrito, sulfuro, y el ion ferroso. Los litotrofos se han observado creciendo en formaciones de rocas a centenares de metros bajo la superficie de la Tierra. El uso de donadores de electrones inorgánicos como fuente de energía es de particular interés en el estudio de la evolución. Este tipo de metabolismo tuvo que ser el predecesor de los actuales modelos de organotrofos.
Deshidrogenasas
Las bacterias pueden usar un gran número de donadores de electrones. Cuando utilizan materia orgánica como fuente de energía, el donador puede ser el NADH o el succinato, en tal caso los electrones entran a la cadena de transporte mediante la NADH deshidrogenasa, que es similar al complejo I mitocondrial, o bien mediante la succinato deshidrogena, que es similar al complejo II. Otras deshidrogenasas pueden ser utilizadas dependiendo del donador; ejemplos pueden ser la formato deshidrogenasa, la lactato deshidrogenasa, la gliceraldehído-3-fosfato deshidrogenasa, H2 deshidrogenasa, también conocida por el nombre de hidrogenasa, y etc. Algunas de estas deshidrogenasas también actúan como bombas de protones, otras simplemente donan los electrones al reservorio de quinonas. La mayoría de las deshidrogenasas son sintetizadas solo en caso de necesidad, por lo que dependiendo del ambiente en el que se encuentra podremos detectar una o varias de estas deshidrogenasas. Las bacterias son capaces por tanto de realizar una regulación transcripcional de las mismas.
Transportadores de quinona
Las quinonas son transportadores móviles liposolubles. En general desempeñan las mismas funciones que la quinona mitocondrial, aunque las bacterias presenten quinonas específicas como son por ejemplo la ubiquinona o la menaquinona.
Bombas de protones
Se considera una bomba de protones cualquier proceso que genere un gradiente de protones a través de la membrana. Los protones pueden ser movidos físicamente a través de la membrana como es el caso de los complejos I y IV de las mitocondrias. El mismo efecto es observado cuando los electrones se mueven en la dirección opuesta, El resultado es la desaparición de protones de la matriz y la aparición de protones en el espacio intermembrana. Este es el caso del complejo III de las mitocondrias, en el cual se observa el ciclo Q. Algunas deshidrogenasas son bombas de protones, otras no. La mayoría de oxidadas y reductasas si lo son, aunque existen excepciones. El citocromo bc1 es una bomba de protones encontrada en muchas bacterias, aunque no en todas, por ejemplo Escherichia coli.
Citocromos
Los citocromos son proteínas que contienen porfirinas que tienen ligado un átomo de hierro. Existen citocromos que son hidrosolubles, otros que son liposolubles. Otra peculiaridad es que existen citocromos móviles como por ejemplo el citocromo c. Aunque la gran mayoría funcionan asociadas a macromoléculas como pueden ser los complejos III y IV.
Oxidasas y reductasas terminales
Cuando una bacteria crece en ambientes aeróbicos, el aceptor final de los electrones es reducido hasta agua por un enzima que se denomina oxidasa. Cuando una bacteria crece en ambientes de hipoxia, el aceptor de electrones es reducido por una enzima que se denomina reductasa. En las mitocondrias el complejo terminal es la citocromo oxidasa, pero las bacterias aeróbicas pueden utilizar varias oxidasas. Escherichia coli, no presenta citocromo oxidasa, por lo que en condiciones aeróbicas utiliza dos quinol oxidasa diferentes para reducir el oxígeno a agua. Ambas quinol oxidasas actúan a su vez como bombas de protones. Las bacterias anaeróbicas no pueden utilizar el oxígeno como aceptor final de los electrones, por lo que requieren reductasas especializadas para cada una de los aceptores. Escherichia coli puede usar, por ejemplo, una fumarato reductasa, la nitrato reductasa, la nitrito reductasa o la DMSO reductasa dependiendo de si existen esos aceptores en el medio en el que estás creciendo.
Aceptores de electrones
Al igual que existen un gran número de donadores de electrones, también existen un gran número de aceptores que pueden ser de ambos tipos, es decir de origen orgánico o inorgánico. Si el oxígeno está disponible, se usará como aceptor, ya que genera mayor producción energética. En los ambientes anaeróbicos, se puede utilizar NO3-, NO2-, Fe3+, SO42-, CO2 y pequeñas moléculas orgánicas como por ejemplo el fumarato.
Resumen
Las cadenas de transporte de electrones bacterianas, son en general, inducibles. Dependiendo del medio en el que estén creciendo las bacterias sintetizarán distintos complejos transmembranas que producirán diferentes transportes en sus membranas.
Cadena de transporte de electrones fotosintética
En la fosforilación oxidativa, los electrones son transferidos desde un donador de electrones de alta energía a un aceptor a través de una cadena de transporte de electrones. En la fotofosforilación, la energía de la luz solar es usada para crear un donador de electrones altamente energético y un aceptor de esos electrones. Los electrones son transferidos desde el donador hasta el aceptor por una cadena de transporte totalmente diferente a la observada en las mitocondrias. La cadena de transporte de electrones fotosintética tiene varias similitudes con la cadena oxidativa. Tienen transportadores móviles, transportadores liposolubles y móviles, transportadores hidrosolubles y bombas de protones, que se encargan de generar el gradiente electroquímico.
Bibliografía básica
- Fenchel T; King GM, Blackburn TH (Sep de 2006). Bacterial Biogeochemistry: The Ecophysiology of Mineral Cycling (2nd ed. edición). Elsevier. ISBN 978-0121034559.
- Lengeler JW; Drews G; Schlegel HG (editors) (Jan de 1999). Biology of the Prokaryotes. Blackwell Science. ISBN 978-0632053575.
- Nelson DL; Cox MM (Apr de 2005). Lehninger Principles of Biochemistry (4th ed edición). W. H. Freeman. ISBN 978-0716743392.
- Nicholls DG; Ferguson SJ (Jul de 2002). Bioenergetics 3. Academic Press. ISBN 978-0125181211.
- Stumm W (1996). Aquatic Chemistry (3rd ed edición). Wiley. ISBN 978-0471511854.
- Thauer RK; Jungermann K; Decker K (Mar 1977). «Energy conservation in chemotrophic anaerobic bacteria». Bacteriol Rev 41 (1): pp. 100-80. PMID 860983.
- White D. (Sep de 1999). The Physiology and Biochemistry of Prokaryotes (2nd ed. edición). Oxford University Press. ISBN 978-0195125795.
- Voet D; Voet JG (Mar de 2004). Biochemistry (3rd ed edición). Wiley. ISBN 978-0471586517.
Referencias
Véase también
Enlaces externos
Wikimedia foundation. 2010.