- Dicloro
-
Dicloro
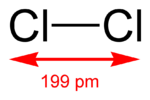
Nombre (IUPAC) sistemático Cloro General Otros nombres Dicloro Fórmula semidesarrollada Cl-Cl Fórmula molecular Cl2 Identificadores Número CAS n/d Propiedades físicas Estado de agregación Gas Apariencia Gas amarillo verdoso Masa molar n/d Punto de fusión 172 K (-101,15 °C) Punto de ebullición 239 K (-34,15 °C) Temperatura crítica 416 K ( °C) Propiedades químicas Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl dicloro (según IUPAC[1] ) o cloro diatómico (también llamado molecular, o simplemente cloro) es una molécula diatómica homonuclear formada por dos átomos de cloro. En condiciones normales de presión y temperatura) es un gas amarillo-verdoso, unas 2,5 veces más pesado que el aire, de olor desagradable y venenoso. El cloro gaseoso es muy tóxico (neumotóxico) y se usó como gas de guerra en la Primera Guerra Mundial (la bertolita), siendo el primer caso de uso de armas químicas.
Contenido
Historia
El cloro (del griego χλωρος, que significa "amarillo verdoso") fue descubierto en su forma diatómica en 1774 por el sueco Carl Wilhelm Scheele, aunque creía que se trataba de un compuesto que contenía oxígeno. Lo obtuvo a partir de la siguiente reacción:
- 2 NaCl + 2H2SO4 + MnO2 → Na2SO4 + MnSO4 + 2 H2O + Cl2
En 1810 el químico inglés Humphry Davy demuestra que se trata de un elemento químico y le da el nombre de cloro debido a su color.
Uso
Se usa como fuente principal para producir ácido clorhídrico (HCl) de la reacción entre cloro e hidrógeno. Se utiliza también para producir cloruro de polivinilo (PVC).
Abundancia y obtención
El dicloro se obtiene principalmente (más del 95% de la producción) mediante la electrólisis de cloruro de sodio (NaCl), en disolución acuosa, denominado proceso del cloro-álcali. Se emplean tres métodos: electrólisis con celda de amalgama de mercurio, electrólisis con celda de diafragma, electrólisis con celda de membrana y mezcla de ácido clorhídrico con hipoclorito de sodio o permanganato de potasio.
Electrólisis con celda de cátodo de mercurio
Fue el primer método empleado para producir cloro a escala industrial.
Se producen pérdidas de mercurio en el proceso generando problemas medioambientales. En las dos últimas décadas del siglo XX se mejoraron los procesos, aunque se siguen perdiendo unos 1,3 gramos de mercurio por tonelada de cloro producida. Por estos problemas medioambientales este proceso se ha ido sustituyendo por el que utiliza una celda de membrana y actualmente supone menos del 20% de la producción mundial de cloro.
Se emplea un cátodo de mercurio y un ánodo de titanio recubierto de platino u óxido de platino. El cátodo está depositado en el fondo de la celda de electrolisis y el ánodo sobre éste, a poca distancia.
La celda se alimenta con cloruro de sodio y, con la diferencia de potencial adecuada, se produce la electrolisis:
- 2Cl– – 2e- → Cl2
- Hg + 2Na+ + 2e– → NaHg
A continuación se procede a la descomposición de la amalgama formada para recuperar el mercurio. La base sobre la que está la amalgama está ligeramente inclinada y de esta forma va saliendo de la celda de electrolisis y se pasa a una torre en donde se añade agua a contracorriente, produciéndose las reacciones:
- H2O + 1e– → 1/2H2 + OH–
- NaHg – 1e– → Na+ + Hg
De esta forma el mercurio se reutiliza.
Con este método se consigue una sosa (NaOH) muy concentrada y un cloro muy puro, sin embargo consume más energía que otros métodos y existe el problema de contaminación por mercurio.
Electrólisis con celda de diafragma
Este método se emplea principalmente en Canadá y Estados Unidos.
Se emplea un cátodo perforado de acero o hierro y un ánodo de titanio recubierto de platino u óxido de platino. Al cátodo se le adhiere un diafragma poroso de fibras de asbesto y mezclado con otras fibras (por ejemplo con politetrafluoroetileno). Este diafragma separa al ánodo del cátodo evitando la recombinación de los gases generados en estos.
Se alimenta el sistema continuamente con salmuera que circula desde el ánodo hasta el cátodo. Las reacciones que se producen son las siguientes:
- 2Cl– – 2e– → Cl2 (en el ánodo)
- 2H+ + 2e– → H2 (en el cátodo)
En la disolución queda una mezcla de NaOH y NaCl. El NaCl se reutiliza y el NaOH tiene interés comercial.
Este método tiene la ventaja de consumir menos energía que el que emplea amalgama de mercurio, pero el inconveniente de que el NaOH obtenido es de menor pureza, por lo que generalmente se concentra. También existe un riesgo asociado al uso de asbestos.
Electrólisis con celda de membrana
Este método es el que se suele implantar en las nuevas plantas de producción de cloro. Supone aproximadamente el 30% de la producción mundial de cloro.
Es similar al método que emplea celda de diafragma: se sustituye el diafragma por una membrana sintética selectiva que deja pasar iones Na+, pero no iones OH– o Cl–.
El NaOH que se obtiene es más puro y más concentrado que el obtenido con el método de celda de diafragma, y al igual que ese método se consume menos energía que en las de amalgama mercurio, aunque la concentración de NaOH sigue siendo inferior,se obtienen concentraciones del 32% a 35%, y es necesario concentrarlo. Por otra parte, el cloro obtenido por el método de amalgama de mercurio es algo más puro. La tercera generación de membranas ya supera en pureza de cloro a las celdas de mercurio.
Precauciones
El cloro provoca irritación en el sistema respiratorio, especialmente en niños y personas mayores. En estado gaseoso irrita las mucosas y en estado líquido quema la piel. Se puede detectar en el aire por su olor a partir de 3,5 ppm, siendo mortal a partir de unos 1000 ppm. Se usó como arma química en la Primera Guerra Mundial.
Una exposición aguda a altas (pero no letales) concentraciones de cloro puede provocar edema pulmonar, o líquido en los pulmones. Una exposición crónica a concentraciones de bajo nivel debilita los pulmones aumentando la susceptibilidad a otras enfermedades pulmonares.
En muchos países se fija como límite de exposición en el trabajo para este gas 0,5 ppm (media de 8 horas diarias, 40 horas a la semana).
Referencias
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre CloroCommons.
Wikimedia Commons alberga contenido multimedia sobre CloroCommons.- ATSDR en Español - ToxFAQs™: cloro
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del cloro.
- Agrupación de Fabicantes de Cloro
Wikimedia foundation. 2010.
