- Fluorocarbono
-
Fluorocarbono
 Algunos fluorocarbonos importantes:
Algunos fluorocarbonos importantes: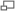
A: fluorometano
B: isoflurano
C: un CFC
D: un HFC
E: ácido tríflico
F: teflón
G: PFOS
H: fluorouracil
I: ProzacLos fluorocarbonos son compuestos químicos que contienen enlaces carbono-flúor. La relativamente baja reactividad y alta polaridad del enlace carbono-flúor los dota de características únicas. Los fluorocarbonos tienden a romperse muy lentamente en el medio ambiente y por tanto muchos se consideran contaminantes orgánicos persistentes. Muchos fluorocarbonos comercialmente útiles también contienen hidrógeno, cloro y bromo.
Contenido
Clases de fluorocarbonos
Clorofluorocarbonos e hidrofluorocarbonos
Los clorofluorocarbonos (CFCs) son fluorocarbonos que también contienes átomos de cloro. Fueron ampliamente usados en la industria como refrigerantes (siendo los más conocidos el diclorodifluorometano y el clorodifluorometano), propelentes y disolventes de limpieza. Sin embargo, los CFCs suelen tener un alto potencial para reducir el ozono gracias principalmente la ruptura homolítica de los enlaces carbono-cloro. Su uso está actualmente prohibido casi totalmente por el Protocolo de Montreal.
Los hidrofluorocarbonos (HFCs) son hidrocarbonos en los que algunos de los átomos de hidrógeno, pero no todos, han sido reemplazados por flúor. Los átomos de flúor no catalizan en estos compuestos la destrucción del ozono, por lo que los HFCs no dañan la capa de ozono. Así, HFCs como el tetrafluoroetano se han convertido en sustitutos favoritos de los CFCs. Estos dañan la capa de ozono.
Fluoropolímeros
Los polímeros de fluorocarbonos también son muy conocidos. Estos polímeros son resistentes, químicamente inertes y eléctricamente aislantes. El ejemplo más famoso es el teflón de DuPont, un polímero del monómero tetrafluoroetileno. Otros polímeros importantes son el fluoruro de polivinilo ([CH2CF2]n) y el policlorotrifluoroetileno ([CFClCF2]n, abreviado PCTFE o Kel-F).
Usos
Anestésicos
Muchos anestésicos volátiles usandos para dejar inconscientes a pacientes de cirugía son fluorocarbonos, como por ejemplo metoxiflurano, enflurano, isoflurano, sevoflurano y desflurano. Los átomos de flúor reducen su inflamabilidad respecto a los anestésicos no fluorados usados originalmente, como el éter dietílico y el ciclopropano, que son muy peligrosos.
Refrigerantes
Algunos fluorocarbonos (por ejemplo el freón) han sido usados como refrigerantes. Estos fluorocarbonos combinan buenas propiedades termodinámicas (con puntos de ebullición por debajo de las temperaturas objetivo típicas, un elevado calor de vaporización, una densidad moderada en su forma líquida y una alta densidad en fase gaseosa) con una naturaleza segura (baja toxicidad e inflamabilidad) y no corrosiva. Debido a sus efectos negativos sobre la capa de ozono, muchos de ellos han sido prohibidos como refrigerantes tras el Protocolo de Montreal.
Propelentes
Los compuestos que tiene puntos de ebullición cercanos a la temperatura ambiente y una presión de vapor alta pueden ser usados como gases propelentes. Algunos fluorocarbonos tienen estas propiedades, por lo que antes del Protocolo de Montreal muchos de ellos se usaban como propelentes.
Disolventes
Los fluorocarbonos se usan como disolventes industriales debidos a sus propiedades específicas: inflamabilidad, estabilidad, excelentes propiedades dieléctricas, baja tensión superficial y baja viscosidad, toxicidad muy baja y perfil medioambiental favorable.
Antes del Protocolo de Montreal se usaban CFCs (como el freón y el clorodifluorometano) como disolventes de limpieza. También se desarrollaron HFCs con propiedades parecidas, que muy a menudo se mezclan con otros fluiodos para lograr propiedades a medida de aplicaciones concretas.
Estas aplicaciones son:
- Limpieza de precisión (desengrasado)
- Descarga de montajes electrónicos
- Retirada de partículas
- Secado tras limpieza acuosa
- Como líquido de trasporte
- Como refrigerante dieléctrico
Los HFCs, particularmente el 1,1,1,2-tetrafluoroetano, se usan para la extracción específica de productos naturales extremadamente importantes, tales como el taxol para el tratamiendo del cáncer de las agujas de tejo, el suplemento dietético de aceite de onagra y la vainilla. El uso del 1,1,1,2-tetrafluoroetano complementa otros métodos de extracción, al ser altamente selectivo y permitir una alta calidad y una alta tasa de extracción.[1]
Lubricantes
Los fluorocarbonos son no reactivos y se usan a menudo para aplicaciones exigentes. Además, los fluoropolímeros sólidos tienen un coeficiente de fricción bajo, mientras los fluidos pueden actuar como lubricantes.
El teflón y otros fluoropolímeros similares se aplican como recubrimiento para reducir la fricción. Las piezas pequeñas y autolubricadas como llave de paso para el material de vidrio de laboratorio pueden fabricarse completamente en teflón.
Productos repelentes de agua y manchas
En general, los compuestos orgánicos altamente fluorados son hidrófobos y tienen propiedades repelentes del agua y las manchas. Las formulaciones originales de productos tales como el Scotchgard contenían fluorocarbonos, como el sulfonato de perfluorobutano y el sulfonato de perfluorooctano (PFOs). Pero muchos de estos usos han sido prohibidos debido a preocupaciones medioambientales, tales como los relacionados con el ácido perfluorooctánico, un intermediario en el fabricación de los PFOs. Similarmente, los productos conteniendo Gore-Tex y teflón se hacen a partir de fluoropolímeros.
Reactivos químicos
El ácido tríflico (CF3SO3H) y el ácido trifluoroacético (CF3CO2H) son reactivos importantes en la síntesis orgánica. Son valiosos por sus propiedades como ácidos muy fuertes solubles en disolventes orgánicos. La naturaleza electronegativa de los átomos de flúor estabiliza los aniones disociados de ácido tríflico y trifluoroacético, llevando a una acidez mayor en comparación con sus análogos no fluorados, respectivamente, los ácidos metanosulfónico y acético. Los átomos de flúor también mejoran la estabilidad térmica y química de las bases conjugadas. De hecho, el análogo polimérico del ácido tríflico, el nafion, se usa como material de intercambio de protones en las células de combustible.
El grupo triflato (la base conjugada del ácido tríflico) es un buen grupo de partida en química orgánica.
Los enlaces carbono-flúor han hallado aplicación en aniones no-coordinantes. En estos aniones (por ejemplo BF4-, PF6-, B(C6H3(CF3)2)4- y B(C6F5)4-) la carga se «corre» entre muchos átomos electronegativos.
Efectos contaminantes
Como se ha mencionada más arriba, los clorofluorocarbonos han sido criticados por el daño que producen a la capa de ozono. Se ha estimado que una sola molécula de CFC tiene capacidad para descomponer aproximadamente 100.000 moléculas de ozono.[2]
Papel biológico
Aunque hay miles de compuestos orgánicos conocidos que ocurren en la naturaleza conteniendo cloro y bromo, sólo hay unos pocos fluorocarbonos naturales.[3] Han sido hallados en microorganismos y plantas, pero no animales. El fluorocarbono natural más común es el ácido fluoroacético, una potente toxina presente en unas pocas especies de plantas. Otros son los ácidos grasos ω-fluorados, la fluoroacetona y el 2-fluorocitrato, de los que se cree que se biosintetizan a partir del ácido fluoroacético.
Dado que el enlace C-F suele ser metabólicamente estable y que el flúor se considera un bioisostero del átomo de hidrógeno, muchos compuestos farmacéuticos contienen estos enlaces. Un ejemplo es el uracilo fluorado. Cuando los átomos de flúor reaccionan con el uracilo se genera 5-fluorouracilo. Este compuesto es una droga anticancerígena (antimetabolito) usado para enmascararse como uracilo durante el proceso de replicación del ácido nucleico[4] Esto puede llevar a la incorporación de 5-fluorouracilo en el ADN y el ARN, así como a la inhibición de las enzimas que son responsables de la síntesis de los componentes normales del ADN. Estos factores pueden ser tóxicos para las células cancerosas que necesitan producir rápidamente ácidos nucleicos normales para poder seguir creciendo.[5]
Algunas drogas muy conocidas que incluyen flúor son la fluoxetina (Prozac), paroxetina (Paxil), ciprofloxacina (Cipro), mefloquina y fluconazol.
Propiedades químicas
La longitud del enlace carbono-flúor es típicamente de unos 1,4 Å (1,39 Å en el fluorometano). Esto es más corto que cualquier otro enlace carbono-halógeno y parecido al enlace carbono-hidrógeno. Debido a que el flúor es un átomo muy electronegativo (mucho más que el carbono), el enlace carbono-flúor tiene un momento dipolar significativo. La energía de disociación de enlace es de 552 kJ/mol para el carbono-flúor, comparados con 397, 228 y 209 kJ/mol de los enlaces del carbono con el cloro, el bromo y el yodo, respectivamente. La fuerza del enlace carbono-flúor es también significativamente mayor que la del enlace carbono-hidrógeno, que es de sólo 338 kJ/mol.
Como resultado de estas propiedades únicas del enlace carbono-flúor, un tema principal en la química de los fluorocarbonos es la comparación del conjunto de propiedades químicas y físicas en relación a los hidrocarbonos correspondientes. Siguen un par de casos de estudio.
Pentaquis(trifluorometil)ciclopentadieno
El pentaquis(trifluorometil)ciclopentadieno (C5(CF3)5H) es un ácido fuerte, con una pKa = −2. Su alta acidez y robustez está indicada por el hecho de que este compuesto se purifica típicamente por destilación del H2SO4. En contraste, base fuerte como el butil-litio para la deprotonación, como es típico para un hidrocarbono.[6] Este compuesto se prepara en una reacción multipaso en tubo único del fluoruro de potasio (KF) con 1,1,2,3,4,4-hexaclorobutadieno.
Hexafluoroacetona y su imina
La molécula hexafluoroacetona ((CF3)2CO), el análogo fluorado de la acetona, tiene un punto de ebullición de -27 °C, en comparación con los +55 °C de ésta. Esta diferencia ilustra uno de los efectos reseñables de reemplazar enlaces C-H con enlaces C-F. Normalmente, el reemplazo de átomos H con halógenos más pesados resulta en puntos de ebullición más altos debido a las mayores interacciones de van der Waals entre las moléculas. Demostrando aún más los importantes efectos de la fluoración, (CF3)2CO forma un hidrato estable y destilable[7] (CF3)2C(OH)2. Las cetonas raramente forman hidratos estables. Siguiendo esta tendencia, (CF3)2CO añade amonio para dar (CF3)2C(OH)(NH2), que puede ser deshidratado con POCl3 para dar (CF3)2CNH.:[8] Los compuestos del tipo R2C=NH son por lo demás bastante raros.
Métodos para preparar fluorocarbonos
Dado que los fluorocarbonos ocurren muy raramente en la naturaleza, deben ser preparados mediante síntesis química. Algunos métodos son:
- Fluoración directa de hidrocarbonos con F2, a menudo altamente diluido con N2.
- R3CH + F2 → R3CF + HF
- Estas reacciones son importantes preparativamente pero requieren precaución porque los hidrocarbonos pueden «arder» incontroladamente en F2, de forma análoga a la combustión en O2. Por ejemplo, el butano arde en una atmósfera de flúor:
- C4H9 + 12.5 F2 → 4 CF4 + 9 HF
- R3CCl + MF → R3CF + MCl (M = Na, K, Cs)
- A partir de reactivos fluorados preformados. Muchos bloques básicos fluorados están disponibles: CF3X (X = Br, I), C6F5Br y C3F7I. Estas especies forman reactivos de Grignard que entonces pueden ser tratados con una variedad de electrófilos.[9]
- Descomposición de tetrafluoroboratos de arildiazonio (reacción de Sandmeyer)[10]
- ArN2BF4 → ArF + N2 + BF3
- Intercambio de flúor y óxido en compuestos carbonilos:
- RCO2H + ↑ Fluorocarbonos y hexafluoro de azufre, sitio mantenido por el European Fluorocarbons Technical Committee (inglés)
- ↑ How ozone is destroyed by CFCs, Oficina de Meteorología, Gobierno de Australia (inglés)
- ↑ D.B. Harper y D. O'Hagan. The Fluorinated Natural Products. Natural Product Reports, 1994, págs. 123-133
- ↑ Garrett, Reginald H.; Grisham, Charles M. Principles of Biochemistry with a Human Focus. Estados Unidos: Brooks/Cole Thomson Learning, 1997
- ↑ Soong, Richiea y Diasio, Robert B. «Advances and challenges in fluoropyrimidine pharmacogenomics and pharmacogenetics». Pharmacogenomics 6(8): 835-847, Diciembre 2005
- ↑ R. D. Chambers, A. J. Roche, J. F.S. Vaughan. «Direct syntheses of Pentakis(trifluoromethyl)cyclopentadienide Salts and Related Systems», Canadian Journal of Chemistry volumen 74, págs. 1925-1929 (1996)
- ↑ Van Der Puy, M.; Anello, L. G. «Hexafluoroacetone» Organic Syntheses Collective Volume 7, pág. 251
- ↑ Middleton, W. J.; Carlson, H. D. «Hexafluoroacetoneimine», Organic Syntheses Collective Volume 6, pág. 664
- ↑ Crombie, A.; Kim, S.-Y.; Hadida, S; Curran, y D. P. «Synthesis of Tris(2-Perfluorohexylethyl)tin Hydride: A Highly Fluorinated Tin Hydride with Advantageous Features of Easy Purification», Organic Syntheses Collective Volume 10, pág. 712
- ↑ Flood, D. T. «Fluorobenzene», Organic Syntheses Collective Volume 2, pág. 295
Categoría: Compuestos orgánicos
Wikimedia foundation. 2010.
