- Amanitina
-
Amanitina 
Nombre (IUPAC) sistemático Ácido (2S, 5R, 6R)-6-amino-3,3-dimetil-7-oxo-4-tia-1-azabiciclo[3.2.0]heptano-2-carboxílico Identificadores Número CAS 23109-05-9 Código ATC ? PubChem 2100 Datos químicos Fórmula C39H54N10O14S Peso mol. 918.97 gr/mol Datos clínicos Cat. embarazo ? Estado legal ? El compuesto alfa-amanitina o α-amanitina es un péptido no ribosomal cíclico de ocho aminoácidos, probablemente una de las toxinas del grupo amatoxinas más letales, encontradas en varias especies del género de hongos amanitas, en particular la oronja verde o Amanita phalloides y Amanita virosa. El compuesto se encuentra también en los hongos Galerina marginata y Conocybe filaris. La dosis mortal para el 50% de los individuos de prueba es aproximadamente 0.1 mg/kg. La α-amanitina es un inhibidor de la ARN polimerasa II,[1] lo que hace que sea una tan letal ponzoña en animales.
La penicilina compite con las amanitinas en el sistema de entrada celular de la membrana del hepatocito, por lo que es un efectivo antídoto contra los efectos del envenenamiento por estos tóxicos aminoácidos.[2]
Contenido
Estructura
La estructura química de la α-amanitina es la de un polipéptido poco típico, debido a las ramificaciones de la cadena de aminoácidos. Dos aminoácidos de triptófano y una cisteína modificados permiten la formación de un segundo lazo cíclico interno, como se observa en la imagen de su estructura química. El lazo más externo es formado por el enlace peptídico normal entre los extremos carboxilo y amino terminales de la cadena.
Además de la α-amanitina, existen otros octapéptidos cíclicos estructuralmente relacionados, llamados β-amanitina y γ-amanitina, todos resistentes a la cocción y altamente hepatotóxicos, cariolíticos e hipoglucemiantes.
Cuadro clínico
La α-amanitina tiene una atracción fuerte y específica, fuera de lo usual, por la enzima ARN polimerasa II. Cuando se ingiere el compuesto, se una a la enzima, causando citólisis efectiva de las células del hígado.[3] Se han reportado solo pocos efectos en las primeras 10 horas, de hecho, no es fuera de lo común que los efectos de importancia no aparezcan sino hasta incluso 24 horas después de la ingesta del compuesto. Este retraso en la aparición de los mortales síntomas hace que sea más difícil diagnosticar el emponzoñamiento. Para cuando aparecen los síntomas, se ha vuelto inútil el lavado gástrico. Los primeros síntomas son diarrea y cólicos, pero estos ceden, dando una falsa impresión de recuperación. Por lo general, al cuarto o quinto día, las toxinas empiezan a tener efecto sobre el hígado y los riñones, conllevando a una insuficiencia de ambos órganos. La muerte ocurre aproximadamente una semana después de la ingesta de la toxina.[4]
Cerca de un 15% de los pacientes envenenados morirán a los 10 días pasando por un estado comatoso y luego insuficiencia hepática, coma hepático, insuficiencia respiratoria y finalmente la muerte. Aquellos que se recuperan tienen aún el riesgo de una insuficiencia hepática.[5]
Mecanismo de acción
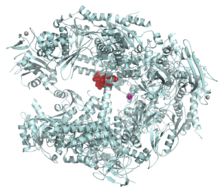 α-Amanitin (red) bound to RNA polymerase II from Saccharomyces cerevisiae (brewer's yeast). From PDB 1K83.[6] .
α-Amanitin (red) bound to RNA polymerase II from Saccharomyces cerevisiae (brewer's yeast). From PDB 1K83.[6] .
Con la estructura de cristal resulta por Bushnell et al.,[6] se sabe que al α-amanitina interactúa con la hélice de la ARN polimerasa II. Esta interacción interfiere con la traslocación del ARN y el ADN necesaria para dejar el sitio de acción de la enzima libre para el siguiente ciclo en la síntesis de ARN. La unión de la α-amanitina puede disminuir la tasas de traslocación de la ARN polimerasa II a una velocidad de solo varios nucleótidos por minuto,[7] [8] aunque tiene poco efecto en la afinidad de la polimerasa por el nucleósido trifosfato,[9] de modo que aún se pueden formar los enlaces fosfodiester.[10] [11] La hélice en cuestión ha evolucionado de modo que es flexible y sus movimientos conformacionales son requeridos para la traslocación de la polimerasa II de la cadena del ADN. El que se una la α-amanitina, le da suficiente rigidez a la molécula, que es lo que le impide la traslocación, reduciendo la velocidad de síntesis de las moléculas de ARN.
Referencias
- ↑ B. Meinecke and S. Meinecke-Tillmann (1993) Journal of Reproduction and Fertility 98:195-201 [1]
- ↑ MUNNE, P.ARTEAGA, J.. [online]. 2008-09-20], pp. 21-48. Disponible en la World Wide Web: [2]. ISSN 1137-6627.
- ↑ D. Michelot and R. Labia (1988) Drug Metabol Drug Interact 6:265-74. [3]
- ↑ A. Mas (2005) Mushrooms Journal of Hepatology 42:166-169 [4]
- ↑ Benjamin DR. Amatoxin syndrome. pp. 198–214. in: Mushrooms: poisons and panaceas — a handbook for naturalists, mycologists and physicians. New York: WH Freeman and Company. 1995.
- ↑ a b Structural basis of transcription: alpha-amanitin-RNA polymerase II cocrystal at 2.8 A resolution. Proc Natl Acad Sci U S A. 2002 Feb 5;99(3):1218-22.
- ↑ Chafin, D. R., Guo, H. & Price, D. H. (1995) J. Biol. Chem. 270, 19114-19119.
- ↑ Rudd, M. D. & Luse, D. S. (1996) J. Biol. Chem. 271, 21549-21558.
- ↑ Cochet-Meilhac, M. & Chambon, P. (1974) Biochim. Biophys. Acta 353, 160-184.
- ↑ Vaisius, A. C. & Wieland, T. (1982) Biochemistry 21, 3097-3101.
- ↑ Gu, W., Powell, W., Mote, J., Jr. & Reines, D. (1993) J. Biol. Chem. 268, 25604-25616.
Categorías:- Péptidos
- Micotoxinas
Wikimedia foundation. 2010.
