- Picoplancton fotosintético
-
Picoplancton fotosintético
El picoplancton fotosintético es la fracción de plancton fotosintético compuesto de células entre 0,2 y 2 µm (picoplancton). Es especialmente importante en las regiones centrales oligotróficas de los océanos donde hay muy bajas concentraciones de nutrientes.
Contenido
Historia
- 1952: descripción de la primera especie picoplanctónica, Chromulina pusilla, por Butcher.[1] Esa especie es renombrada en 1960 a Micromonas pusilla[2] y hoy es reconocida como una de las más abundantes en aguas templadas oceánicas
- 1979 : Waterbury descubre el Synechococcus marino[3] y Johnson & Sieburth lo confirman con microscopía electrónica.[4]
- 1982 : Johnson & Sieburth demuestran la importancia de los pequeños eucariotes con microscopio electrónico[5]
- 1983 : W.K. Li y Platt muestran que una gran fracción de la producción primaria marina es debida a organismos menores a 2 µm[6]
- 1986 : se descubren los "Prochlorophytes" por Chisholm & Olson en el mar de los Sargazos,[7] nombrados en 1992 como Prochlorococcus marinus[8]
- 1994 : se descubre en el lago Thau de Francia el eucariote fotosintético más pequeño hasta la fecha: Ostreococcus tauri, por Courties.[9]
- 2001 : a través del secuenciado del gen ARN ribosómico extraído de muestras marinas, varios grupos europeos descubren que el picoplancton eucariótico es altamente diverso[10] [11]
Métodos de estudio
Debido a su tamaño extremadamente pequeño , el picoplancton es difícil de estudiar por los métodos clásicos tales como el microscopio óptico. Se necesitan métodos más complejos y costosos.
- El Microscopio de epifluorescencia permite detectar ciertos grupos de células que poseen pigmentos fluorescentes tales como Synechococcus que tiene ficoeritrina
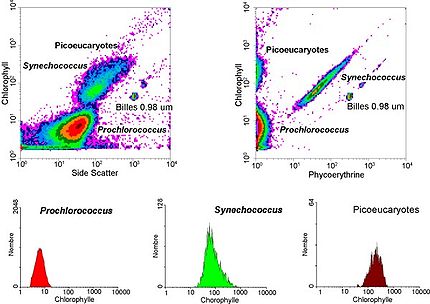
- Citometría de flujo: mide tamaños y fluorescencia de entre 1.000 a 10.000 células/segundo. Permite determinar muy fácilmente la concentración de varias poblaciones de picoplancton en muestras marinas. Se pueden distinguir tres grupos de células: Prochlorococcus, Synechococcus, picoeucariotes. Por ej. Synechococcus se caracteriza por su doble fluorescencia debido a sus pigmentos: naranja por la ficoeritrina y roja por la clorofila. Esta citometría también permite separar poblaciones específicas (por ej. Synechococcus) para ponerlo en cultivo, o realizar análisis más detallados.
- Análisis de pigmentos fotosintéticos tales como clorofila o carotenoides por cromatografía de alta precisión (HPLC) permitiendo determinar los varios grupos de algas presentes en una muestra
- Técnicas de Biología molecular:
-
- Clonación y secuenciación de genes tales los del ARN ribosómico, que permiten determinar la diversidad total dentro de una muestra.
- DGGE (Electroforesis con gel desnaturalizado), que es más rápido que los estudios previos permitiendo dar una idea de la diversidad global dentro de una muestra
- Hibridación In situ (FISH) usando probetas fluorescentes reconociendo taxones específicos, por ej. una especie, un género o una clase[12]
- PCR en tiempo real puede usarse, como también FISH, para determinar, la abundancia de grupos específicos. Su mayor ventaja es la de permitir el rápido análisis de muchas muestras simultáneamente,[13] aunque requiere controles y calibraciones más complejos .
Composición
Tres grupos principales de organismos constituyen el picoplancton fotosintético.
- Cyanobacteria del género Synechococcus, con un tamaño de 1 µm (micrómetro) que fue descubierto en 1979 por J. Waterbury[3] (Institución Oceanográfica de Woods Hole). Son sumamente ubicuos, aunque más abundantes en aguas relativamente mesotróficas.
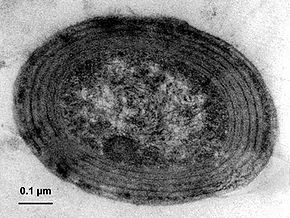
- Cyanobacteria del género Prochlorococcus que son particularmente notables. Tamaño típico de 0,6 µm, Prochlorococcus fue descubierta recién en 1988[7] por dos investigadores estadounidenses, Sallie W. Chisholm (Massachusetts Institute of Technology) y por R.J. Olson (Institución Oceanográfica de Woods Hole). A pesar de su minúsculo tamaño, este organismo fotosintético es indudablemente el más abundante del planeta: en verdad su densidad puede llegar a 100 millones de células/L y puede ser hallada a profundidades de más de 150 m en todo el cinturón intertropical.[14]
- Eukaryota picoplanctónica: es la menos conocida, demostrada en los recientes descubrimientos de los grupos mayores. Andersen crea en 1993 una nueva clase de algas marrones, las Pelagophyceae.[15] Más sorpresivo aún es el descubrimiento de 1994[9] de una eucariota de muy pequeño tamaño, Ostreococcus tauri, dominando la biomasa fitoplanctónica de un lago francés salobre (estanque de Thau), muestra que esos organismos pueden jugar también un rol ecológico mayor en ambientes costeros. En 1999, aún una nueva clase de alga es descubierta,[16] genéticamente muy emparentadas con diatomeas, pero bastante diferentes morfológicamente. Al presente, se conocen cerca de 50 especies dentro de varias clases.
-
-
-
Clases de algas con especies picoplanctónicas Clases Géneros picoplanctónicos Chlorophyceae Nannochloris Prasinophyceae Micromonas , Ostreococcus, Pycnococcus Prymnesiophyceae Imantonia Pelagophyceae Pelagomonas Bolidophyceae Bolidomonas Dictyochophyceae Florenciella
-
-
Estas propuestas implementadas desde los 1990s para bacterias, se aplicaron a los Picoeukaryota fotosintéticos solo 10 años más tarde; revelando una muy amplia diversidad[10] [11] y poniendo luz a la importancia de los siguientes grupos en el picoplancton :- Prasinophyceae
- Haptophyta
- Cryptophyta
En ambientes templados costeros, el género Micromonas (Prasinophyceae) parece dominante. Sin embargo, en numerosos ambientes oceánicos, la especie dominante de picoplancton eucariótico permanece aún sin conocerse.[12]
Ecología
Cada población de picoplancton ocupa un nicho ecológico específico en el ambiente oceánico.
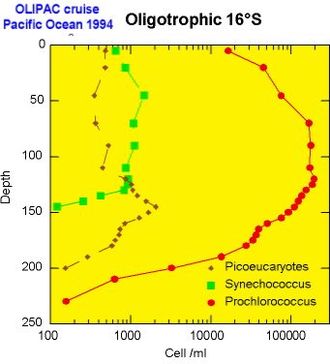
- La cyanobacteria Synechococcus es generalmente abundante en ambientes mesotróficos, por ejemplo en la vecindad de surgencias ecuatoriales o en regiones costeras.
- La cyanobacteria Prochlorococcus reemplaza cuando las aguas se empobrecen en nutrientes (i.e. oligotrófico). Por otro lado en regiones templadas (por ej. en el océano Atlántico Norte),Prochlorococcus está ausente debido a que las aguas frías impiden su desarrollo.
- La diversidad de eukaryota, corresponde indudablemente a una gran variedad de ambientes. En regiones oceánicas, son frecuentemente observados a profundidades de la base de capas (como la capa "eufótica"). En regiones costeras, ciertas clases de picoeucaryota como "Micromonas" dominan. Su abundancia sigue a ciclos estacionales, como el plancton de tamaño mayor, con su máximo en el estío.
En los 1970s, se había hipotetizado que la velocidad de las divisiones celulares de microorganismos en los ecosistmas oceánicos centrales era muy baja, del orden de una semana a un mes. Hipótesis que se consolidó por la razón de que la biomasa (estimada por ejemplo por lose contenidos de clorofila) era muy estable en el tiempo. Sin embargo al descubrirse el picoplancton, se encuentra que el sistema era mucho más dinámico de lo previamente pensado. En particular, pequeños predadores de un tamaño de pocos micrómetros que ingieren algas picoplanctónicas tan rápido a medida que se producen, se hallaron como bien ubicuas. Este extremadamente complejo sistema predador-presa está prácticamente siempre en equilibrio y resulta así en una biomasa de picoplancton casi-constante. Esta perfecta equivalencia entre producción y consumo hace extremadamente difícil medir con precisión la velocidad a la que el sistema interactua.
En 1988, do investigadores estadounidenses, Carpenter & Chang, sugieren estimar la velocidad de las divisiones celulares del fitoplancton siguiendo el curso del replicado del ADN por microscopía; y reemplazándolo por un citómetro de flujo, es posible seguir el contenido de ADN de las células de picoplancton en el tiempo. Eso permitió establecer que las células del picoplancton son extremadamente sincrónicas: replican su ADN y luego se dividen todas al mismo tiempo al fin del día. Esa sincronización podría deberse a la presencia de un reloj interno biológico circadiano.
Genómica
En los 2000s, la genómica permitió cruzar a un estadio suplementario. La Genómica consiste en determinar la secuencia completa de un genoma de un organismo, listando cada gen presente. Así será posible tene una idea de las capacidades metabólicas de organismos en la mira y entender como se adapta a su ambiente. Así, los genomas de varios tipos de Prochlorococcus[17] [18] y de Synechococcus,[19] yb con una raza de Ostreococcus[20] se han determinado, mientras varias otras cyanobacterias y diminutos eukaryota (Bathycoccus, Micromonas) están bajo secuenciado. En paralelo, el análisis genómico comienza a ser hecho directamente de muestras oceánicas (ecogenómica o metagenómica),[21] permitiendo el acceso a grandes sets de genes de organismos no cultivados.
-
-
-
Genomas de razas de picoplancton fotosintético
que ya se han secuenciadoGénero Raza Centro de Secuenciado Nota Prochlorococcus MED4 JGI SS120 Genoscope MIT9312 JGI MIT9313 JGI NATL2A JGI CC9605 JGI CC9901 JGI Synechococcus WH8102 JGI WH7803 Genoscope RCC307 Génoscope CC9311 TIGR [22] Ostreococcus OTTH95 Genoscope
-
-
Enlaces internos
- Pitoplancton
- Bacterioplancton
- Anexo:especies de picoplancton fotosintético
- Picoeucariote
- Bentos
- Necton
- Seston
- Oceanografía
- Zooplancton
- Ictioplancton
- Plancton
Referencias
- ↑ Butcher, R. (1952). Contributions to our knowledge of the smaller marine algae. Journal of the Marine Biological Association UK 31: 175-91.
- ↑ Manton, I. & Parke, M. (1960). Further observations on small green flagellates with special reference to possible relatives of Chromulina pusilla Butcher. Journal of the Marine Biological Association UK 39: 275-98.
- ↑ a b Waterbury, J. B. et al. (1979). Wide-spread occurrence of a unicellular, marine planktonic, cyanobacterium. Nature 277: 293-4.
- ↑ Johnson, P. W. & Sieburth, J. M. (1979). Chroococcoid cyanobacteria in the sea: a ubiquitous and diverse phototrophic biomass. Limnology and Oceanography 24: 928-35.
- ↑ Johnson, P. W. & Sieburth, J. M. (1982). In-situ morphology and occurrence of eucaryotic phototrophs of bacterial size in the picoplankton of estuarine and oceanic waters. Journal of Phycology 18: 318-27.
- ↑ Li, W. K. W. et al. (1983). Autotrophic picoplankton in the tropical ocean. Science 219: 292-5.
- ↑ a b Chisholm, S. W. et al. (1988). A novel free-living prochlorophyte occurs at high cell concentrations in the oceanic euphotic zone. Nature 334: 340-3.
- ↑ Chisholm, S. W. et al. (1992). Prochlorococcus marinus nov. gen. nov. sp.: an oxyphototrophic marine prokaryote containing divinyl chlorophyll a and b. Archives of Microbiology 157: 297-300.
- ↑ a b Courties, C. et al. (1994). Smallest eukaryotic organism. Nature 370: 255.
- ↑ a b López-García, P. et al. (2001). Unexpected diversity of small eukaryotes in deep-sea Antarctic plankton. Nature 409: 603-7.
- ↑ a b Moon-van der Staay, S. Y. et al. (2001). Oceanic 18S rDNA sequences from picoplankton reveal unsuspected eukaryotic diversity. Nature 409: 607-10.
- ↑ a b Not, F. et al. (2004). A single species Micromonas pusilla (Prasinophyceae) dominates the eukaryotic picoplankton in the western English Channel. Applied and Environmental Microbiology 70: 4064-72.
- ↑ Johnson, Z. I. et al. (2006). Niche partitioning among Prochlorococcus ecotypes along ocean-scale environmental gradients. Science 311: 1737-40.
- ↑ Partensky, F. et al. (1999). Prochlorococcus, a marine photosynthetic prokaryote of global significance. Microbiology and Molecular Biology Reviews 63: 106-27.
- ↑ Andersen, R. A. et al. (1993). Ultrastructure and 18S rRNA gene sequence for Pelagomonas calceolata gen. and sp. nov. and the description of a new algal class, the Pelagophyceae classis nov. Journal of Phycology 29: 701-15.
- ↑ Guillou, L. et al. (1999). Bolidomonas: el nuevo género con dos especies de la nueva clase de algas, las Bolidophyceae (Heterokonta). Journal of Phycology 35: 368-81.
- ↑ Rocap, G. et al. (2003). Genome divergence in two Prochlorococcus ecotypes reflects oceanic niche differentiation. Nature 424: 1042-7.
- ↑ Dufresne, A. et al. (2003). Genome sequence of the cyanobacterium Prochlorococcus marinus SS120, a nearly minimal oxyphototrophic genome. Proceedings of the National Academy of Sciences of the United States of America 100: 10020-5.
- ↑ Palenik, B. et al. (2003). The genome of a motile marine Synechococcus. Nature 424: 1037-42.
- ↑ Derelle, E. et al. (2006). Genome analysis of the smallest free-living eukaryote Ostreococcus tauri unveils many unique features. Proceedings of the National Academy of Sciences of the United States of America 103: 11647-52.
- ↑ Venter, J. C. et al. (2004). Environmental genome shotgun sequencing of the Sargasso Sea. Science 304: 66-74.
- ↑ Palenik, B. et al. (2006). Genome sequence of Synechococcus CC9311: Insights into adaptation to a coastal environment. PNAS 103: 13555-9.
Otras referencias
Cyanobacteria
- Zehr, J. P., Waterbury, J. B., Turner, P. J., Montoya, J. P., Omoregie, E., Steward, G. F., Hansen, A. & Karl, D. M. 2001. Unicellular cyanobacteria fix N2 in the subtropical North Pacific Ocean. Nature 412:635-8
Eucariotes
- Butcher, R. 1952. Contributions to our knowledge of the smaller marine algae. J. Mar. Biol. Assoc. UK. 31:175-91.
- Manton, I. & Parke, M. 1960. Further observations on small green flagellates with special reference to possible relatives of Chromulina pusilla Butcher. J. Mar. Biol. Assoc. UK. 39:275-98.
- Eikrem, W., Throndsen, J. 1990. The ultrastructure of Bathycoccus gen. nov. and B. prasinos sp. nov., a non-motile picoplanktonic alga (Chlorophyta, Prasinophyceae) from the Mediterranean and Atlantic. Phycologia 29:344-350
- Chrétiennot-Dinet, M. J., Courties, C., Vaquer, A., Neveux, J., Claustre, H., et al. 1995. A new marine picoeucaryote: Ostreococcus tauri gen et sp nov (Chlorophyta, Prasinophyceae). Phycologia 34:285-292
- Sieburth, J. M., M. D. Keller, P. W. Johnson, and S. M. Myklestad. 1999. Widespread occurrence of the oceanic ultraplankter, Prasinococcus capsulatus (Prasinophyceae), the diagnostic "Golgi-decapore complex" and the newly described polysaccharide "capsulan". J. Phycol. 35: 1032-1043
Ecología
- Platt, T., Subba-Rao, D. V. & Irwin, B. 1983. Photosynthesis of picoplankton in the oligotrophic ocean. Nature 300:701-4
- Stomp M, Huisman J, de Jongh F, Veraart AJ, Gerla D, Rijkeboer M, Ibelings BW, Wollenzien UIA, Stal LJ. 2004. Adaptive divergence in pigment composition promotes phytoplankton biodiversity. Nature 432: 104-107
- Campbell, L., Nolla, H. A. & Vaulot, D. 1994. The importance of Prochlorococcus to community structure in the central North Pacific Ocean. Limnol. Oceanogr. 39:954-61
Biología molecular y Genomas
- Rappé, M. S., P. F. Kemp, and S. J. Giovannoni. 1995. Chromophyte plastid 16S ribosomal RNA genes found in a clone library from Atlantic Ocean seawater. J. Phycol. 31: 979-988
- Todo o parte de este artículo fue creado a partir de la traducción del artículo Photosynthetic picoplankton de la Wikipedia en inglés, bajo licencia Creative Commons Compartir Igual 3.0. y GFDL.
Categorías: Oceanografía | Planctología | Ecología acuática | Algas
Wikimedia foundation. 2010.