- Piruvato deshidrogenasa
-
Piruvato deshidrogenasa
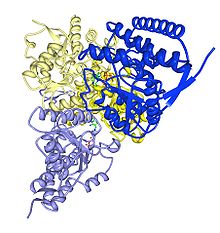
Piruvato deshidrogenasa humana cadenas alfa y beta. PDB 1NI4. Piruvato deshidrogenasa (acetil transferidora) subunidad alfa.Identificadores Símbolo PDHA1 Símbolos alt. PDHA Entrez 5160 HUGO 8806 OMIM 300502 PDB 1NI4 RefSeq NM_000284 UniProt P08559 Otros datos Número EC 1.2.4.1 Locus Cr. X p22.1 Piruvato deshidrogenasa (acetil transferidora) subunidad alfa específica de los testículos.Identificadores Símbolo PDHA2 Símbolos alt. PDHAL Entrez 5161 HUGO 8807 OMIM 179061 PDB 1NI4 RefSeq NM_005390 UniProt P29803 Otros datos Número EC 1.2.4.1 Locus Cr. 4 q22-q23 Piruvato deshidrogenasa (acetil transferidora) subunidad beta.Identificadores Símbolo PDHB Entrez 5162 HUGO 8808 OMIM 179060 PDB 1NI4 RefSeq NM_000925 UniProt P11177 Otros datos Número EC 1.2.4.1 Locus Cr. 3 p21.1-p14.2 Se han reconocido hasta la fecha tres tipos de piruvato deshidrogenasa.
- Piruvato deshidrogenasa (acetil transferidora) o PDH.
- Piruvato deshidrogenasa (NADP+).
- Piruvato deshidrogenasa (citocromo).
En los tres tipos, su función es realizar la descarboxilación oxidativa del piruvato a acetato desprendiéndose dióxido de carbono.
Contenido
Piruvato deshidrogenasa (acetil transferidora)
La enzima Piruvato deshidrogenasa (acetil transferidora) o PDH EC 1.2.4.1 cataliza la reacción de descarboxilación oxidativa del piruvato utilizando como cofactor la tiamina difosfato.
- Piruvato + (dihidrolipoil-lisina-residuo acetiltransferasa]-lipoil-lisina
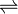 (dihidrolipoil-lisina-residuo acetiltransferase)-S-acetildihidrolipoil-lysina + CO2
(dihidrolipoil-lisina-residuo acetiltransferase)-S-acetildihidrolipoil-lysina + CO2
Forma parte del complejo multienzimático piruvato deshidrogenasa siendo la unidad E1 del mismo. Los otros componentes del complejo son la dihidrolipoil-lisina-residuo acetiltransferasa (DLAT) y la dihidrolipoil deshidrogenasa (DLD) como componentes E2 y E3 respectivamente.
Tipos de PDH's humanas
En los humanos existen tres genes que codifican la PDH.
- PDHA1. Piruvato deshidrogenasa cadena alfa. Tiene una longitud de 390 aminoácidos. La deficiencia en PDHA1 es causa de la Deficiencia en piruvato descarboxilasa componente E1 (Deficiencia en PDHE1). La deficiencia en PDHE1 es el más común de los defectos enzimáticos en pacientes como acidosis láctica primaria. Está asociada con fenotipos clínicos variables desde la muerte neonatal hasta la supervivencia prolongada complicada por retraso en el desarrollo, convulsiones, ataxia y apnea. La deficiencia en PDHA1 también es causa del Síndrome de Leigh ligado al cromosoma X (LS). El LS es un síndrome neurodegenerativo progresivo de temprana aparición con una neuropatología característica consistente en lesiones focales y bilaterales en una o más regiones del sistema nervioso central, incluyendo el tronco del encéfalo, tálamo, ganglios basales, cerebelo y médula espinal. Las lesiones son áreas de demielinación, gliosis, necrosis, espongiosis o proliferación capilar. Los síntomas clínicos dependen de que áreas del sistema nervioso central estén afectadas. La causa común de todas las lesiones es un defecto en la fosforilación oxidativa. La LS puede ser causa de una deficiencia de cualquiera de los complejos de la cadena respiratoria mitocondrial.
- PDHA2. Piruvato deshidrogenasa cadena alfa específica de los testículos. Tiene una longitud de 388 aminoácidos y se expresa en las células espermatogénicas postmeióticas.
- PDHB. Piruvato deshidrogenasa cadena beta. Existen dos isoformas de este polipéptido. La isoforma 1 tiene 359 aminoácidos y la 2 341. La deficiencia en PDHB es causa de la Deficiencia en PDHE1.
La enzima se presenta formando tetrámeros de dos unidades alfa y dos unidades beta. Su localización celular es la matriz mitocondrial.
Regulación
La actividad de la enzima se regula mediante la fosforilación de la cadena alfa (inactivación) llevada a cabo por la piruvato deshidrogenasa kinasa y defosforilación de la cadena alfa (activación) llevada a cabo por la piruvato deshidrogenasa fosfatasa.
La PDH es estimulada por la insulina, fosfoenolpiruvato y AMP, pero es completamente inhibida por el ATP, NADH y acetil-CoA.
Conformación y reacciones
Los datos bioquímicos y estructurales para la PDH revelan un mecanismo de activación del cofactor tiamina pirofosfato (TPP) formando un puente de hidrógeno conservado con un residuo glutamato (Glu59 en la forma humana) e imponiendo una conformación en V que lleva al átomo N4' de la aminopirimidina a la distancia requerida para formar los enlaces hidrógeno intramoleculares con el átomo C2 del tiazolio. Esta combinación única de contactos y conformaciones del TPP lleva eventualmente a la formación de un carbanión-C2 reactivo.
Después de que el TPP reacciona con el piruvato, sufriendo descarboxilación, la porción se convierte en un derivado hidroxietilo unido covalentemente al TPP.
En la segunda reacción, la PDH transfiere dos electrones y el grupo acetilo se agrupa con el segundo sustrato, el ácido lipoico. Este reduce el ácido lipoico oxidizado y transfiere el grupo acetilo al grupo lipolil para formar un tioéster acetico.
Piruvato deshidrogenasa (NADP+)
La enzima Piruvato deshidrogenasa (NADP+) EC 1.2.1.51 cataliza la reacción de descarboxilación oxidativa del piruvato según la siguiente ecuación.
- Piruvato + CoA + NADP+
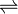 Acetil-CoA + CO2 + NADPH
Acetil-CoA + CO2 + NADPH
Esta enzima es inhibida por el oxígeno. Se presenta como un homodímero y se une a una molécula de FAD, a una molécula de FMN y a la tiamina pirofosfato. Esta presente en organismos como la Anabaena variabilis, Chlorobium chlorochromatii, Cryptosporidium parvum (Q968X7), Entamoeba dispar y Euglena gracilis (Q94IN5).
Piruvato deshidrogenasa (citocromo)
La enzima Piruvato deshidrogenasa (citocromo) EC 1.2.2.2 cataliza la reacción de descarboxilación oxidativa del piruvato según la siguiente ecuación.
- Piruvato + Ferricitocromo b1 + H2O
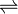 Acetato + CO2 + Ferrocitocromo b1
Acetato + CO2 + Ferrocitocromo b1
Es una enzima bacterial y se presenta como un homotetrámero al que se une una molécula de FAD, una molécula de tiamina pirofosfato y un ion magnesio. Su localización celular es la membrana celular y se aciva por digestión proteolítica limitada.
Enlaces externos
- Pyruvate dehydrogenase (acetyl-transferring) (en inglés).
- Pyruvate dehydrogenase (NADP+) (en inglés).
- Pyruvate dehydrogenase (cytochrome) (en inglés).
Categorías: Genes del cromosoma X | Genes del cromosoma 4 | Genes del cromosoma 3 | Oxidorreductasas
Wikimedia foundation. 2010.
