- Insulina
-
Insulina 
HUGO 6081 Símbolo INS Datos genéticos Locus Cr. 11 p15.5 Bases de datos Entrez 3630 OMIM 176730 RefSeq NM_000207 UniProt P01308 La insulina (del latín insula, "isla") es una hormona polipeptídica formada por 51 aminoácidos,[1] producida y secretada por las células beta de los islotes de Langerhans del páncreas, en forma de precursor inactivo llamado proinsulina. Esta pasa al aparato de Golgi, donde se modifica, eliminando una parte y uniendo los dos fragmentos restantes mediante puentes disulfuro. La insulina interviene en el aprovechamiento metabólico de los nutrientes, sobre todo con el anabolismo de los carbohidratos. Su déficit provoca la diabetes mellitus y su exceso provoca hiperinsulinismo con hipoglucemia.
Gran número de estudios demuestran que la insulina es una alternativa segura, efectiva, bien tolerada y aceptada para el tratamiento a largo plazo de la diabetes tipo 1 y la diabetes tipo 2, incluso desde el primer día del diagnóstico.[2]
Frederick Grant Banting, Charles Best, James Collip, y J.J.R. Macleod de la Universidad de Toronto, Canadá, descubrieron la insulina en 1922. El Doctor Banting recibió el Premio Nobel de Fisiología o Medicina por descubrir esta hormona aunque se demostro que el verdadero descubridor fue Nicolae Paulescu en 1921.
Contenido
Funciones
 1.Preproinsulina (Lguía, B cadena, C cadena, A cadena); proinsulina consiste BCA, sin L 2.plegamiento espontáneo 3.Cadenas A y B unidas por puentes sulfuros 4.Guía y la cadena C son cortadas 5.Restos de insulina
1.Preproinsulina (Lguía, B cadena, C cadena, A cadena); proinsulina consiste BCA, sin L 2.plegamiento espontáneo 3.Cadenas A y B unidas por puentes sulfuros 4.Guía y la cadena C son cortadas 5.Restos de insulina
La insulina es una hormona "anabólica" por excelencia: permite disponer a las células del aporte necesario de glucosa para los procesos de síntesis con gasto de energía. De esta glucosa, mediante glucólisis y respiración celular se obtendrá la energía necesaria en forma de ATP. Su función es la de favorecer la incorporación de glucosa de la sangre hacia las células: actúa siendo la insulina liberada por las células beta del páncreas cuando el nivel de glucosa en sangre es alto. El glucagón, al contrario, actúa cuando el nivel de glucosa disminuye y es entonces liberado a la sangre. Por su parte, la Somatostatina, es la hormona encargada de regular la producción y liberación tanto de glucagón como de insulina. La insulina se produce en el Páncreas en los "Islotes de Langerhans", mediante unas células llamadas Beta. Una manera de detectar si las células beta producen insulina, es haciendo una prueba, para ver si existe péptido C en sangre. El péptido C se libera a la sangre cuando las células Beta procesan la proinsulina, convirtiéndola en insulina. Cuando sólo entre un 10% y un 20% de las células Beta están en buen estado, comienzan a aparecer los síntomas de la diabetes, pasando primero por un estado previo denominado luna de miel, en el que el páncreas aún segrega algo de insulina.
La insulina tiene una importante función reguladora sobre el metabolismo, sobre el que tiene los siguientes efectos:
- Estimula la glucogenogénesis.
- Inhibe la gluconeogénesis y la glucogenolisis.
- Promueve la glucólisis.
- Favorece la síntesis de triacilgleceroles (triglicéridos). Para ello, estimula la producción de acetil-CoA (por ejemplo, al acelerar la glucólisis), y también estimula la síntesis de ácidos grasos (componentes de los triacilgliceroles) a partir de la acetil-CoA.
- Estimula la síntesis de proteínas.
Genética
La proinsulina, precursora de la insulina, es codificada por el gen INS,[3] [4] [5] localizado en el cromosoma 11p15.5.[6] Se han identificado una variedad de alelos mutantes en la región que codifica al gen. También se han descrito varias secuencias reguladoras a nivel de la región promotora del gen de la insulina humana sobre la cual se unen los factores de transcripción. En general, se sabe que las cajas A se unen a factores Pdx1, que las cajas E se unen a NeuroD, las cajas C sobre MafA y que las secuencias denominadas elementos de respuesta al cAMP se unen sobre los factores de transcripción CREB. Se han descubierto también varios silenciadores genéticos que inhiben la transcripción de la insulina.
Secuencias reguladoras y sus factores de transcripción para el gen de la insulina.[7] Secuencias reguladoras Factores de transcripción ILPR Par1 Caja A5 Pdx1 Elemento regulatorio negativo (NRE)[8] Receptor glucocorticoide, Oct1 Caja Z (sobrepuesto a NRE y C2) ISF C2 Pax4, MafA(?) E2 USF1/USF2 A3 Pdx1 A2 - CAAT enhancer binding (CEB) (parcialmente sobrepuesto a A2 y C1) - C1 - E1 E2A, NeuroD1, HEB A1 Pdx1 G1 - Estructura
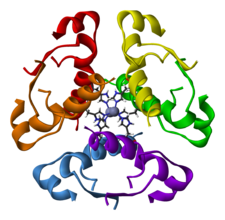 Ilustración de la configuración hexamérica de la insulina, es decir, producida por agregados de tres pares de hormonas unidas entre sí a través de la cadena B en presencia de zinc, en forma antiparalela, no covalente, pero estable.[9]
Ilustración de la configuración hexamérica de la insulina, es decir, producida por agregados de tres pares de hormonas unidas entre sí a través de la cadena B en presencia de zinc, en forma antiparalela, no covalente, pero estable.[9]
Entre los vertebrados, la insulina conserva una íntima similitud estructural. Por ejemplo, la insulina bovina difiere de la humana en solo tres aminoácidos, mientras que la porcina difiere solo en uno, por lo tanto, las insulinas de procedencia animal tienen la misma efectividad que la humana.[10] La insulina de ciertas especies de peces es lo suficientemente similar a la humana que es clínicamente efectiva para uso en humanos. Aún la insulina del invertebrado Caenorhabditis elegans una nematoda, es muy similar en estructura, tiene efectos celulares muy parecidos y se produce de manera análoga a la de los humanos. De modo que es una proteína que se ha preservado a lo largo de la evolución del tiempo, sugiriendo su rol fundamental en el control metabólico animal. El péptido C, producto del desdoblamiento de la proinsulina, difiere considerablemente entre las diferentes especies, por lo que, aunque es también una hormona, tiene un papel secundario.
La conformación estructural de la insulina es esencial para su actividad como hormona. La insulina es sintetizada y almacenada en el cuerpo en forma de un hexámero, es decir, una unidad compuesta por seis insulinas, mientras que su forma activa es la de una hormona monomérica, es decir, la molécula de insulina sola.[10] Seis moléculas de insulina permancen inactivas por largo tiempo en su forma hexamérica, como forma de almacenamiento de disponibilidad rápida y protección de la altamente reactiva molécula de insulina. Dentro del aparato de Golgi, la proinsulina es enviada al interior de vesículas secretoras y de almacenamiento ricas en Zn2+ y Ca2+. Una vez en la vesícula se forman especies hexaméricas de la proinsulina con dos átomos de zinc por cada hexámero de proinsulina: (Zn2+)2(Ca2+)(Proin)6, las cuales son posteriormente convertidas en el hexámero de insulina: (Zn2+)2(Ca2+)(In)6—por acción de enzimas proteolíticas y produciendo también la proteína C.[11]
La conversión entre la forma hexamérica y la monomérica es una de las características fundamentales de las fórmulas de inyección de la insulina. El hexámero es mucho más estable que la hormona sola, por lo que sería una presentación más práctica, sin embargo, el monómero es la forma más reactiva de la hormona porque su difusión es mucho más rápida haciendo que no se tenga que administrar varios minutos (30-60) antes de las comidas.[12] La presentación con la insulina más reactiva le da a los diabéticos la opción de tener comidas diarias en horas más flexibles. Ciertos preparados de insulina tienen variaciones en al menos dos aminoácidos de modo que cuando la insulina se inyecta, ésta tenga una menor tendencia de formar agregados hexaméricos y su acción sea rápida y su efecto breve.
Síntesis
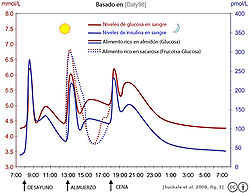
La insulina se sintetiza en las células beta del páncreas y se libera bajo la influencia de varios estímulos, entre ellos, la ingesta de proteínas y glucosa y su paso a la sangre a partir de los alimentos digeridos. Muchos carbohidratos producen glucosa, aumentando sus niveles en el plasma sanguíneo y estimulando de inmediato la liberación de insulina a la circulación portal.[9] También se ha demostrado que la hormona de crecimiento es capaz de aumentar la secreción de insulina humana.[13] En las células diana—principalmente en el hígado, músculo y tejido adiposo—se inicia una transducción de señales cuyo efecto es el incremento en la captación de glucosa y su posterior almacenamiento, evitando así un ascenso excesivo de la glucemia postprandial.[14] Con la reducción de la concentración circulante de glucosa, se degrada la insulina secretada, finalizando así la respuesta unas 2 o 3 horas después de la ingesta.[9]
La porción exocrina del páncreas está conformada por acinos serosos que representan la mayor parte de la masa de la glándula. Las células beta hacen parte de los islotes de Langerhans (Las células beta son el 70% de todas las células endocrinas) que constituyen la porción endocrina del páncreas (2% de todo el parénquima), haciendo entonces que el páncreas sea fundamentalmente una glándula mixta.
En las células beta, la insulina se sintetiza a partir de proinsulina, una molécula precursora, por acción de enzimas proteolíticas conocidas como convertasas prohormonas, específicamente la convertasa proproteína 1 y la convertasa proproteína 2, así como la exoproteasa carboxipeptidasa E.[15] Ciertas modificaciones ejercidas sobre la proinsulina le eliminan una región del centro de la molécula denominada péptido C quedando libres los extremos C-terminal y N-terminal. Estos extremos libres tienen 51 aminoácidos en total y se denominan cadenas A (21 aminoácidos) y B (30 aminoácidos), los cuales terminan unidas entre sí por medio de enlaces disulfuro.[9] De modo que la proinsulina consta de las cadenas B-C-A y los gránulos secretorios liberan las tres cadenas simultáneamente.
La producción endógena de insulina es regulada en varios pasos a lo largo de una ruta sintética. Primero sobre la transcripción del ADN, específicamente a nivel del gen de la insulina. Luego a nivel de la estabilidad del ARNm y a nivel de la traducción del ARNm. Finalmente, también se regula a nivel de las modificaciones postransducción.
Se ha demostrado que la insulina y sus proteínas relacionadas son producidas también dentro del cerebro y que niveles muy reducidas de estas proteínas pueden estar asociadas a la enfermedad de Alzheimer.[16] [17] [18]
Liberación de la insulina
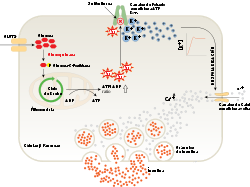
Las células beta de los islotes de Langerhans liberan la insulina en dos fases. La primera fase de la liberación de insulina se desencadena rápidamente en respuesta al aumento de los niveles de glucosa en la sangre. La segunda fase produce una liberación sostenida y lenta de de las recién formadas vesículas que se activan independientemente de la cantidad de azúcar en la sangre.
En la primera fase la liberación de la insulina ocurre de manera inmediata:[19]
- La glucosa entra en la células beta a través del transportador de glucosa GLUT2[12]
- La glucosa pasa a la glucólisis y el ciclo respiratorio, donde se producen, por oxidación, varias moléculas de ATP de alta energía
- Los canales de potasio (K+) dependientes de los niveles de ATP y, por tanto, de los niveles de glucosa en sangre, se cierran y la membrana celular se despolariza[12] [19]
- Con la despolarización de la membrana, los canales de calcio (Ca2+) dependientes de voltaje se abren y el calcio entra la célula[19]
- Un aumento en el nivel de calcio intracelular produce la activación de fosfolipasa C, que desdobla los fosfolípidos de membrana fosfatidil inositol 4,5-bifosfato en inositol 1,4,5-trifosfato y diacilglicerol[20]
- El inositol 1,4,5-trifosfato (IP3) se une a los receptores proteicos sobre la membrana del retículo endoplásmico (RE). Esto permite la liberación de Ca2+ del RE a través de los canales IP3 aumentando más aún la concentración intracelular de calcio
- Estas cantidades significativamente mayores de calcio dentro de las células provoca la activación de la sinaptotagmina, que ayuda a la liberación de la insulina previamente sintetizada y almacenada en las vesículas secretoras.
Este es el principal mecanismo para la liberación de insulina. Cierta liberación de insulina ocurre además con la ingesta de alimentos, no sólo de glucosa o hidratos de carbono, y las células beta son también en cierta medida influenciadas por el sistema nervioso autónomo. Los mecanismos de señalización que controlan estos vínculos no son del todo comprendidos.
Otras sustancias que pueden estimular la liberación de insulina incluyen los aminoácidos de las proteínas ingeridas, la acetilcolina—liberada de las terminaciones nervio vago (sistema nervioso parasimpático)—, la colecistoquinina—secretada por células enteroendocrinas de la mucosa intestinal—y el péptido insulinotrópico dependiende de glucosa (GIP). Tres aminoácidos (alanina, glicina y arginina) actúan de manera similar a la glucosa alterando el potencial de membrana de la célula beta. La acetilcolina desencadena la liberación de insulina a través de la fosfolipasa C, mientras que la colecistoquinina actúa a través del mecanismo de adenilato ciclasa.
El sistema nervioso simpático, a través de la estimulación de receptores adrenérgicos alfa 2, como lo demuestran los agonistas de la clonidina o la metildopa, inhiben la liberación de insulina. Sin embargo, cabe señalar que la adrenalina circulante activará los receptores Beta 2 en las células beta de los islotes pancreáticos para promover la liberación de insulina. Esto es importante ya que los músculos no pueden beneficiarse de los incrementos de glucosa en la sangre como consecuencia de la estimulación adrenérgica (aumento de la gluconeogénesis y glucogenolisis con los niveles bajos de la insulina en sangre: por el glucagón) a menos que la insulina está presente para permitir la translocación GLUT-4 a nivel de los tejidos. Por lo tanto, comenzando con la inervación directa, la noradrenalina inhibe la liberación de insulina a través de los receptores alfa2 y, subsecuentemente, la adrenalina circulante proveniente de la médula suprarrenal estimulará los receptores beta2-promoviendo así la liberación de insulina.
Cuando el nivel de glucosa se reduce al valor fisiológico normal, la liberación de insulina de las células beta frena o se detiene. Si los niveles de glucosa en sangre se vuelven inferior a ese nivel, especialmente a niveles peligrosamente bajos, la liberación de hormonas hiperglicémicas, la más prominente de las cuales es el glucagón de los mismos islotes de Langerhans pero de células alfa, obligan a la liberación de glucosa en la sangre a partir de los almacenes celulares, principalmente el almacenamiento de glucógeno en las células del hígado. Mediante el aumento de glucosa en la sangre, las hormonas hiperglucémicas previenen o corrigen la hipoglucemia que pone en peligro la vida del individuo. La liberación de insulina está fuertemente inhibida por la hormona del estrés noradrenalina, lo que conduce a un aumento de los niveles de glucosa en sangre durante momentos de estrés.
Pruebas de alteración de la primera fase de liberación de insulina se pueden detectar en la prueba de tolerancia a la glucosa, demostrado por una sustancial elevación de nivel de glucosa en sangre en los primeros 30 minutos, un marcado descenso durante los siguientes 60 minutos, y un constante ascenso de nuevo a los niveles de referencia en las siguientes horas.
Clasificación
Normalmente las insulinas sintéticas se sintetizan por medio de ingeniería genética a través de ADN. Hay un cierto desacuerdo sobre la eficacia de la insulina sintética comparada con la insulina derivada de las fuentes animales.
En la diabetes tipo I, y en algunos casos en la tipo II se hace necesaria la inyección de insulina para mantener un nivel correcto de glucosa en sangre. Existen los siguientes tipos de insulinas:
- Insulinas de acción rápida de tapa verde.
- Insulinas de acción corta de tapa morada llamada cristalina.
- Insulinas de acción intermedia o NPH.
- Insulinas de acción prolongada.
En muchos casos se combina el tratamiento con estos tipos de insulina.
También por su zona de inyección las podemos clasificar como:
- Insulinas subcutáneas: Cualquier insulina, ya sea de acción rápida o retardada.
- Insulinas endovenosas: Solo las insulinas de acción rápida que no poseen retardantes.
Dependiendo del retardante utilizado podemos clasificar las insulinas de la siguiente manera:
- Insulinas que utilizan zinc como retardante.
- Insulinas que utilizan otras proteínas como la protamina como retardantes.
Nuevos tipos de insulina
Los científicos han intentado por todos los medios conseguir tipos de insulina que no tengan que ser inyectados, procurando así hacer la vida de los enfermos algo más fácil.
Insulina inhalada
En enero de 2006 se aprobó por la Comisión Europea la primera versión de insulina inhalada para el tratamiento de la diabetes tipo 1 y tipo 2. Se trataba de la primera opción terapéutica inhalada y por tanto no inyectable desde el descubrimiento de la insulina. Se planteó como una alternativa para aquellos pacientes que por diversas razones no toleraban aceptablemente un tratamiento mediante inyecciones o pastillas. Desde su introducción, no se consideró por algunos tan eficaz como la tradicional (subcutánea), ya que ésta se mide en centímetros cúbicos (cc) y la actual, en unidades (UI). Además al ser inhalada, no se sabe la cantidad exacta que se absorbe. Este tipo de insulina podría mejorar la calidad de vida del paciente diabético y disminuir las inyecciones y lo penoso e invasivo que resultan. No está recomendada en niños ni en ancianos. Por otra parte, no excluiría de todas las inyecciones de insulina; los diabéticos insulinodependientes deberían seguir pinchándose algunas veces, siguiendo la pauta de su médico. La utilidad y valor de la insulina inhalada era más clara para quienes disfrutan de menos inyecciones en las piernas, brazos, abdomen, etc.
Sin embargo, en octubre de 2007, apenas a unos meses de haber comenzado su comercialización en España, Pfizer, laboratorio responsable de Exubera (nombre comercial de la insulina inhalada), decidió la retirada del mercado mundial del producto por no haber satisfecho sus expectativas económicas.
Noticias sobre la insulina
Últimamente se ha descubierto que en las células madre del cordón umbilical se produce insulina. Un estudio realizado por investigadores estadounidenses y británicos concluye que las células madre obtenidas del cordón umbilical de recién nacidos pueden ser manipuladas para producir insulina y que en el futuro es posible que se empleen para tratar la diabetes.
La investigación fue dirigida por el Dr. Randall Urban, de la University of Texas Medical Branch (Estados Unidos), quien explican que fueron los primeros en conseguir cultivar grandes cantidades de células madre y dirigirlas para que se asemejaran a células beta productoras de insulina. A juicio del Dr. Urban, "este descubrimiento nos muestra que tenemos el potencial de producir insulina a partir de células madre adultas para ayudar a las personas con diabetes".
El estudio se publica en "Cell Proliferation" y, según los investigadores, ofrece una alternativa al uso de células madre embrionaria.
Véase también
Referencias
- ↑ Ronald J. Gillespie; Aurelio Beltrán; David A. Humphreys; N. Colin Baird; Edward A. Robinson (1988). Química. Reverté S.A.. pp. 550. ISBN 9788429171884. http://books.google.es/books?id=dlGugYOOwxQC&printsec=frontcover.
- ↑ [Brooks (Reuters Health), citado por MedlinePlus] (septiembre de 2009). «Médicos de EEUU derriban mitos sobre la insulina» (en español). Enciclopedia médica en español. Consultado el 22 de septiembre de 2009.
- ↑ «Entrez Gene: INS insulin».
- ↑ Bell GI, Pictet RL, Rutter WJ, Cordell B, Tischer E, Goodman HM (March 1980). «Sequence of the human insulin gene». Nature 284 (5751): pp. 26–32. doi:. PMID 6243748.
- ↑ Moreno Esteban, Basilio; Susana Monereo Megías y Julia Álvarez Hernández (2000) (en español). Obesidad (2da edición). Ediciones Díaz de Santos. pp. 94. ISBN 847978430X.
- ↑ Roca, Alfredo Jácome (2005) (en español). Fisiología endocrina (2da edición). Academia Nal. De Medicina. pp. 34. ISBN 9589731295. http://books.google.es/books?id=FTu0A0y54t4C&source=gbs_navlinks_s.
- ↑ Melloul D, Marshak S, Cerasi E (2002). «Regulation of insulin gene transcription». Diabetologia 45 (3): pp. 309–26. doi:. PMID 11914736.
- ↑ Jang WG, Kim EJ, Park KG, Park YB, Choi HS, Kim HJ, Kim YD, Kim KS, Lee KU, Lee IK (2007). «Glucocorticoid receptor mediated repression of human insulin gene expression is regulated by PGC-1alpha». Biochem. Biophys. Res. Commun. 352 (3): pp. 716–21. doi:. PMID 17150186.
- ↑ a b c d EYZAGUIRRE C, Francisca y CODNER, Ethel. Análogos de insulina: en búsqueda del reemplazo fisiológico. Rev. méd. Chile [online]. 2006, vol.134, n.2 [citado 2009-08-01], pp. 239-250 . Disponible en: [1]. ISSN 0034-9887.
- ↑ a b Lüllmann, Heinz; Klaus Mohr (2006) (en español). Atlas de Farmacología. Elsevier, España. pp. 264. ISBN 8445811606. http://books.google.es/books?id=Ac2Cn1w96PwC&source=gbs_navlinks_s.
- ↑ Dunn, M. F. (agosto 2005). «Zinc-ligand interactions modulate assembly and stability of the insulin hexamer - a review». BioMetals 18 (4): pp. 295–303. http://www.ingentaconnect.com/content/klu/biom/2005/00000018/00000004/00003685?crawler=true. Consultado el 1 de agosto de 2009.
- ↑ a b c Behrman, Richard E.; Robert M Kliegman y Hal B. Jenson (2004) (en español). Nelson Tratado de Pediatría (17ma edición). Elsevier, España. pp. 509, 1955. ISBN 8481747475. http://books.google.es/books?id=6a_lLbxRKwkC&source=gbs_navlinks_s.
- ↑ PIERLUISSI, José, DE PIERLUISSI, Raiza y DE MARTÍNEZ, Ángela. ENHANCEMENT OF INSULIN SECRETORY RESPONSE TO GLUCOSE-DEPENDENT INSULINOTROPIC POLYPEPTIDE (GIP) BY GROWTH HORMONE IN DOGS. ACV. [online]. ene. 2002, vol.53, no.1 [citado 19 septiembre de 2009], p.29-35. Disponible en la World Wide Web: [2]. ISSN 0001-5504.
- ↑ Baynes, John W.; Marek H. Dominiczak (2005) (en español). Bioquímica médica (2da edición). Elsevier, España. pp. 279. ISBN 8481748668. http://books.google.co.ve/books?id=OCWP08sZok4C&source=gbs_navlinks_s.
- ↑ Steiner DF, Oyer PE (February 1967). «The biosynthesis of insulin and a probable precursor of insulin by a human islet cell adenoma». Proc. Natl. Acad. Sci. U.S.A. 57 (2): pp. 473–480. doi:. PMID 16591494.
- ↑ Gustin N (07-03-2005). «Researchers discover link between insulin and Alzheimer's». EurekAlert!. American Association for the Advancement of Science. Consultado el 01-01-2009.
- ↑ de la Monte SM, Wands JR (February 2005). «Review of insulin and insulin-like growth factor expression, signaling, and malfunction in the central nervous system: relevance to Alzheimer's disease». J. Alzheimers Dis. 7 (1): pp. 45–61. PMID 15750214. http://iospress.metapress.com/openurl.asp?genre=article&issn=1387-2877&volumen=7&número=1&spage=45.
- ↑ Steen E, Terry BM, Rivera EJ, Cannon JL, Neely TR, Tavares R, Xu XJ, Wands JR, de la Monte SM (February 2005). «Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease--is this type 3 diabetes?». J. Alzheimers Dis. 7 (1): pp. 63–80. PMID 15750215. http://iospress.metapress.com/openurl.asp?genre=article&issn=1387-2877&volumen=7&número=1&spage=63.
- ↑ a b c Kumar, Vinay; Ramzi S. Cotran y Stanley L. Robbins (2005) (en español). Patología humana (7ma edición). Elsevier, España. pp. 1195. ISBN 8481748412. http://books.google.com/books?id=i2o24JW40wAC&source=gbs_navlinks_s.
- ↑ Berg, Jeremy; Lubert Stryer, John Tymoczko (2005) (en español). Bioquímica (7ma edición). Reverté. pp. 1051. ISBN 8429176004. http://books.google.com/books?id=HRr4MNH2YssC&source=gbs_navlinks_s.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre InsulinaCommons.
Wikimedia Commons alberga contenido multimedia sobre InsulinaCommons.- En MedlinePlus puede encontrar más información sobre Insulina
Categorías:- Genes del cromosoma 11
- Hormonas peptídicas
- Productos biotecnológicos
- Código ATC A
- Páncreas
- Insulinas
Wikimedia foundation. 2010.