- Isocitrato deshidrogenasa
-
Isocitrato deshidrogenasa (NADP+) citoplasmática HUGO 5382 Símbolo IDH1 Datos genéticos Locus Cr. 2 q32-qter Bases de datos Número EC 1.1.1.42 Entrez 3417 OMIM 147700 PDB 1T09 RefSeq NM_005896 UniProt O75874 Isocitrato deshidrogenasa (NADP+) mitocondrial HUGO 5383 Símbolo IDH2 Datos genéticos Locus Cr. 15 q21-qter Bases de datos Número EC 1.1.1.42 Entrez 3418 OMIM 147650 RefSeq NM_002168 UniProt P48735 Isocitrato deshidrogenasa (NAD+), subunidad alfa HUGO 5384 Símbolo IDH3A Datos genéticos Locus Cr. 15 q25.1-q25.2 Bases de datos Número EC 1.1.1.41 Entrez 3419 OMIM 601149 RefSeq NM_005530 UniProt P50213 Isocitrato deshidrogenasa (NAD+), subunidad beta HUGO 5385 Símbolo IDH3B Datos genéticos Locus Cr. 20 [1] Bases de datos Número EC 1.1.1.41 Entrez 3420 OMIM 604526 RefSeq NM_174856 UniProt O43837 Isocitrato deshidrogenasa (NAD+), subunidad gamma HUGO 5386 Símbolo IDH3G Datos genéticos Locus Cr. X q28 Bases de datos Número EC 1.1.1.41 Entrez 3421 OMIM 300089 RefSeq NM_004135 UniProt P51553 La enzima Isocitrato deshidrogenasa (IDH) es una enzima importante del metabolismo de los carbohidratos participante en el ciclo de Krebs que cataliza la descarboxilación oxidativa del isocitrato en 2-oxoglutarato. La IDH es dependiente del NAD+ o NADP+. En los eucariotas existen al menos tres isozimas de la IDH.
- IDH2 - Isocitrato deshidrogenasa dependiente del NADP+ mitocondrial, EC 1.1.1.42.
- IDH3 - Isocitrato deshidrogenasa dependiente del NAD+, EC 1.1.1.41, en los humanos formada por las subunidades alfa, beta y gamma.
En la Escherichia coli la actividad de la enzima dependiente del NADP+ está controlada por la fosforilación de un residuo serina llevada a cabo por la isocitrato deshidrogenasa kinasa. La forma fosforilada de IDH está completamente desactivada.
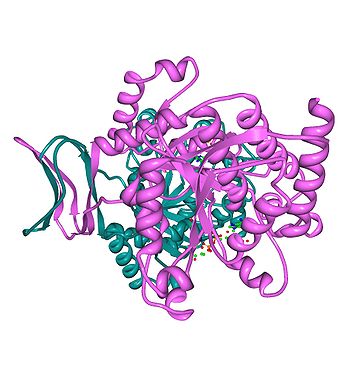 Estructura 3D de un homodímero de IDH1 - Isocitrato deshidrogenasa dependiente del NADP+ citoplasmática. PDB 1T09.
Estructura 3D de un homodímero de IDH1 - Isocitrato deshidrogenasa dependiente del NADP+ citoplasmática. PDB 1T09.
Contenido
IDH1
La IDH1 cataliza las reacciones de descarboxilación oxidativa del isocitrato y del oxalosuccinato utilizando exclusivamente NADP+ como aceptor de electrones. El oxalosuccinato es uno de los intermedios de reacción del isocitrato.
- Isocitrato + NADP+
 2-oxoglutarato + CO2 + NADPH
2-oxoglutarato + CO2 + NADPH
- Oxalosuccinato + NADP+
 2-oxoglutarato + CO2 + NADPH
2-oxoglutarato + CO2 + NADPH
La proteína humana tiene una longitud de 414 aminoácidos y se presenta en homodímeros que necesitan por cada uno la unión de un catión magnesio o manganeso. Su localización celular es el citoplasma o el peroxisoma.
IDH2
Es la variante mitocondrial de la IDH1. Cataliza las reacciones de descarboxilación oxidativa del isocitrato y del oxalosuccinato utilizando también exclusivamente NADP+ como aceptor de electrones. La proteína humana tiene una longitud de 452 aminoácidos y se presenta en homodímeros que necesitan por cada uno la unión de un catión magnesio o manganeso.
Participa en el metabolismo intermedio y en la producción de energía estando estrechamente asociada o interaccionando con el complejo piruvato deshidrogenasa.
IDH3
La IDH3 solamente cataliza la reacción de descarboxilación oxidativa del isocitrato utilizando exclusivamente NAD+ como aceptor de electrones.
- Isocitrato + NAD+
 2-oxoglutarato + CO2 + NADH
2-oxoglutarato + CO2 + NADH
Su localización celular es la mitocondria y se presenta en heteroligómeros de las subunidades alfa, beta y gamma en un ratio 2:1:1. Cada heteroligómero necesita de la unión de un catión magnesio o manganeso. Las características de cada cadena son:
- La cadena alfa se presenta en dos isoformas (1 y 2) siendo la longitud de cada una de ellas 366 y 288 aminoácidos respectivamente.
- La cadena beta también se presenta en dos isoformas (B y A) siendo la longitud de cada una de ellas 385 y 383 aminoácidos respectivamente.
- La cadena gamma tiene una longitud de 393 aminoácidos. Se activa incrementando el ratio ADP/ATP y por la presencia del ion Ca+2.
La IDH3 se regula alostéricamente.
Regulación
El cambio de energía libre para la reacción catalizada por la IDH es de -8,4 kJ/gmol, por tanto se puede considerar una reacción irreversible con lo que debe ser regulada cuidadosamente para evitar un consumo excesivo de isocitrato y una acumulación de 2-oxoglutarato. La reacción es estimulada por el mecanismo simple de disponibilidad de sustrato (isocitrato, NAD (P)+, Mg+2 / Mn+2), inhibida por producto (2-oxoglutarato y NAD (P) H) e inhibida por ATP por inhibición competitiva feedback.
Mecanismo catalítico
En el transcurso del ciclo de Krebs, el isocitrato, producido por la isomerización del citrato, es oxidado y descarboxilado. La enzima IDH rodea en su sitio activo al isocitrato mediante los aminoácidos arginina, tirosina, asparagina, serina, treonina y ácido aspártico.
La primera etapa de la reacción es la oxidación del carbono alfa (C#2) del isocitrato formándose oxalosuccinato.[1] [2] En este proceso[1] el grupo alcohol de este carbono es deprotonado, los electrones fluyen hacia el carbono formándose un grupo cetona y se elimina un ion hidruro usando NAD+/NADP+ como cofactor aceptor de electrones.
La segunda etapa es la descarboxilación del oxalosuccionato. En esta etapa[1] [2] el oxígeno del grupo carboxilo es deprotonado por un residuo tirosina cercano y los electrones fluyen hacia el carbono 2. El dióxido de carbono deja el carbono beta del isocitrato, los electrones fluyen hacia el oxígeno del grupo cetona cargándose éste negativamente y por último se forma un doble enlace entre los carbonos alfa y beta.
La tercera etapa es la saturación del doble enlace entre los carbonos 2 y 3. En esta etapa,[1] [2] un residuo de lisina deprotona el oxígeno del carbono alfa regenerándose el enlace cetona y formándose un enlace simple entre los carbonos alfa y beta cogiendo un protón de un residuo tirosina cercano.[3]
Sitio activo
La estructura de la isocitrato deshidrogenasa de la Escherichia coli fue la primera estructura en ser construida y entendida.[3] Ya que la Escherichia coli ha sido usada por muchos investigadores para hacer comparaciones con otras isocitrato deshidrogenasas. Hay mucho conocimiento detallado sobre esta enzima bacterial y se ha encontrado que muchas isocitrato deshidrogenasas son similares en estructura y por lo tanto en funcionalidad. Esta similaridad de estructura y función da razones para creer que las estructuras y los aminoácidos están conservados,[4] por tanto los sitios activos entre muchas isocitrato deshidrogenasas procariotas deberían estar conservados y así se ha observado a través de muchos estudios realizados en enzimas procariotas.
Por otro lado las isocitrato deshidrogenasas eucariotas no han sido estudiadas completamente. Cada dímero de IDH tiene dos sitios activos[3] al que cada uno enlaza una molécula de NAD+/NADP+ y un ion metal (Mg+2, Mn+2). En general cada sitio activo tiene una secuencia conservada de aminoácidos para cada sitio de unión específico. En las enzimas de la Desulfotalea psychrophila (DpIDH)[3] y en la del cerdo (PcIDH)[5] hay tres sustratos unidos al sitio activo.
- El isocitrato se une en el sitio activo a una secuencia de aproximadamente ocho aminoácidos a través de puentes de hidrógeno. Estos aminoácidos incluyen tirosina, serina, asparagina, arginina, tirosina y leucina. Sus posiciones pueden variar pero todos están situados en un rango cercano. Por ejemplo Arg131 DpIDH y Arg133 PcIDH, Tyr138 DpIDH y Tyr140 PcIDH.[3]
- El ion metal se une con tres residuos conservados a través de puentes de hidrógeno. Estos aminoácidos son tres residuos aspartato.[3]
- El NAD+ y NADP+ se unen en el sitio activo en cuatro regiones con propiedades similares entre las enzimas IDH. Estas regiones varían pero están alrededor de [250-260], [280-290], [300-330] y [365-380].[3]
Referencias
- ↑ a b c d McMurry, John E., and Tadhg P. Begley. The Organic Chemistry of Biological Pathways. Englewood, Colorado: Roberts and Company, 2005. 189-190.
- ↑ a b c Nelson, David L., and Michael M. Cox. Lehninger Principles of Biochemistry. New York: W. H. Freeman and Company, 2005. 609-611.
- ↑ a b c d e f g Fedoy AE, Yang N, Martinez HKSL, Steen IH (2007). «Structural and Functional Properties of Isocitrate Dehydrogenase from the Psychrophilic Bacterium Desulfotalea psychrophila Reveal a Cold-active Enzyme with an Unusual High Thermal Stability». Journal of Molecular Biology 372 (372): pp. 130–149. doi:.
- ↑ Yasutake Y, Watanabe S, Yao M, Takada Y, Fukunaga N, Tanaka I (2003). «Crystal Structure of the Monomeric Isocitrate Dehydrogenase in the Presence of NADP+». Journal of Biological Chemistry 278 (38): pp. 36897–36904. doi:. PMID 12855708.
- ↑ Ceccarelli C, Neil B (2002). «The Crystal Structure of Porcine Mitochondrial NADP+-dependent Isocitrate Dehydrogenase Complexed with Mn2+ and Isocitrate». Journal of Biological Chemistry 277 (45): pp. 43454–43462. doi:. PMID 12207025.
Enlaces externos
- Isocitrato deshidrogenasa (NAD+) en NiceZyme (en inglés).
- Isocitrato deshidrogenasa (NADP+) en NiceZyme (en inglés).
Categorías:- Genes del cromosoma 2
- Genes del cromosoma 15
- Genes del cromosoma 20
- Genes del cromosoma X
- Oxidorreductasas
Wikimedia foundation. 2010.