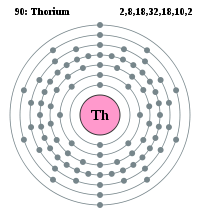
- Torio
-
Actinio - Torio - Protactinio Ce
Th
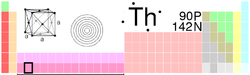
Tabla completaGeneral Nombre, símbolo, número Torio, Th, 90 Serie química Actínidos periodo, bloque 7 , f Densidad, dureza Mohs 11724 kg/m3, 3,0 Apariencia Blanco plateado Propiedades atómicas Masa atómica 232,0381 u Radio medio† 180 pm Radio atómico calculado Sin datos Radio covalente Sin datos Radio de Van der Waals Sin datos Configuración electrónica [Rn]6d27s2 Estados de oxidación (óxido) 4 base débil Estructura cristalina Cúbica centrada en las caras Propiedades físicas Estado de la materia Sólido (_) Punto de fusión 2028 K Punto de ebullición 5061 K Entalpía de vaporización 514,4 kJ/mol Entalpía de fusión 16,1 kJ/mol Presión de vapor Sin datos Velocidad del sonido 2490 m/s a 293,15 K Información diversa Electronegatividad 1,3 (Pauling) Calor específico 120 J/(kg·K) Conductividad eléctrica 6,53 × 106 m-1·Ω-1 Conductividad térmica 54 W/(m·K) 1er potencial de ionización 587 kJ/mol 2° potencial de ionización 1110 kJ/mol 3er potencial de ionización 1930 kJ/mol 4° potencial de ionización 2780 kJ/mol Isótopos más estables iso. AN Periodo de semidesintegración MD ED MeV PD 228Th Sintético 1,9116 años α 5,520 224Ra 229Th Sintético 7340 años α 5,168 225Ra 230Th Sintético 75380 años α 4,770 226Ra 232Th 100 1,405 × 1010 años α 4,083 228Ra 234Th Traza 24,1 días β- 234Pa Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.El torio es un elemento químico, de símbolo Th y número atómico 90. Es un elemento de la serie de los actínidos que se encuentra en estado natural en los minerales monazita, torita y torianita. En estado puro es un metal blando de color blanco-plata que se oxida lentamente. Si se tritura finamente y se calienta, arde emitiendo luz blanca.[1]
El torio pertenece a la familia de las substancias radiactivas, lo que significa que su núcleo es inestable y tras cierto tiempo se transforma en otro elemento. Por ello tiene potencial para ser utilizado en el futuro como combustible nuclear pero esa aplicación todavía está en fase de desarrollo.
Contenido
Historia
El torio se llamó así en honor a Thor, el dios nórdico del relámpago y la tormenta. Fue aislado por primera vez en 1828 por Jöns Jakob Berzelius. En la última década del siglo XIX los investigadores Pierre Curie y Marie Curie descubrieron que el torio emitía radiactividad.[2]
Aplicaciones del torio
Aparte de su incipiente uso como combustible nuclear el torio metálico o alguno de sus óxidos se utilizan en las siguientes aplicaciones:[3]
- Se incorpora al tungsteno metálico para fabricar filamentos de lámparas eléctricas
- Para aplicaciones en material cerámico de alta temperatura
- Para la fabricación de lámparas electrónicas
- Como agente de aleación en estructuras metálicas
- Como componente básico de la tecnología del magnesio
- Como catalizador en química orgánica
- Para fabricar electrodos especiales de soldadura (TIG-Tugsten Inert Gas o WIG), aleando al Tungsteno (Wolframio) favoreciendo una mayor emisividad de electrones por parte del electrodo, lo que facilita el encendido y permite que el electrodo de Wolframio trabaje a una menor temperatura con el mismo rendimiento sobre la pieza a trabajar (existe el problema de que la temperatura del trabajo del electrodo de wolframio puro era aproximadamente la temperatura de fusión del wolframio de 3400 °C, lo que acababa dañando el perfil del electrodo al fundirse). Un problema del uso de electrodos dopados con Torio es la leve radiactividad que acaba produciendo cáncer a largo plazo en los soldadores [cita requerida] (por esto es recomendable usar electrodos con otros dopantes como Cerio, Lantánido o Circonio).
- Se utiliza en la industria electrónica como detector de oxígeno.[cita requerida]
Fisión del torio
Cuando un átomo de torio 232 se desintegra emite una partícula alfa, formada por dos protones y dos neutrones. La emisión de la partícula alfa reduce el número atómico del torio 232 en dos unidades, y el número másico en cuatro, transformándolo en el isótopo 228 de otro elemento, el radio 228. Posteriores desintegraciones forman la serie del torio. Este proceso continúa hasta que se forma finalmente un elemento no radiactivo, y por tanto estable, que es el plomo.
El periodo de semidesintegración del torio 232 es muy elevado por lo que libera radiactividad durante miles de millones de años.
Para poder aprovechar la radiactividad del torio como fuente de energía, habría que transformar el torio 232 en uranio 233. Esta conversión puede llevarse a cabo en reactores especiales (reactores rápidos y reactores subcríticos).[cita requerida]
Véase también
- Reactor nuclear
- Fisión nuclear
- Plutonio
- Radiactividad
- Uranio
- Radioisótopos
Referencias y bibliografía
- ↑ Educaplus.org. «Elementos químicos: Torio». Consultado el 24-03-2011.
- ↑ Historia del torio
- ↑ Aplicaciones del torio
Enlaces externos
- ATSDR en Español - ToxFAQs™: Torio Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Torio Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- EnvironmentalChemistry.com - Thorium
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del torio.
- Los Alamos National Laboratory - Thorium
- The Uranium Information Centre
- Torio, Nueva Fuente de Energía
- WebElements.com - Thorium
Categorías:- Elementos químicos
- Actínidos
- Carcinógenos
- Materiales superconductores
- Materiales nucleares
- Torio
Wikimedia foundation. 2010.