- Cerio
-
Cerio
Lantano - Cerio - Praseodimio Ce
Th
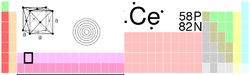
General Nombre, símbolo, número Cerio, Ce, 58 Serie química Lantánidos Periodo, bloque 6, d Densidad, dureza Mohs 6689 kg/m3, 2,5 Apariencia Blanco plateado

Propiedades atómicas Masa atómica 140,116 u Radio medio† Sin datos Radio atómico calculado 185 pm Radio covalente Sin datos Radio de Van der Waals Sin datos Configuración electrónica [Xe]4f15d16s2 Estados de oxidación (óxido) 3,4 (levemente básico) Estructura cristalina Cúbica centrada en las caras Propiedades físicas Estado de la materia Sólido Punto de fusión 1071 K (798°C) Punto de ebullición 3699 K (3426°C) Entalpía de vaporización 414 kJ/mol Entalpía de fusión 5,46 kJ/mol Presión de vapor _ Pa a 1071 K Velocidad del sonido 2100 m/s a 293,15 K Información diversa Electronegatividad 1,12 (Pauling) Calor específico 190 J/(kg·K) Conductividad eléctrica 1,15 × 106 m-1·Ω-1 Conductividad térmica 11,4 W/(m·K) 1er potencial de ionización 534,4 kJ/mol 2° potencial de ionización 1050 kJ/mol 3er potencial de ionización 1949 kJ/mol 4° potencial de ionización 3547 kJ/mol Isótopos más estables iso. AN Periodo de semidesintegración MD ED MeV PD 134Ce Sintético 3,16 días ε 0,500 134La 136Ce 0,185% Cerio es estable con 78 neutrones 138Ce 0,251% Cerio es estable con 80 neutrones 139Ce Sintético 137,640 días ε 0,278 139La 140Ce 88,450% Cerio es estable con 82 neutrones 141Ce Sintético 32,501 días β- 0,581 141Pr 142Ce 11,114% >5 × 1016 años β- desconocido 142Nd 144Ce Sintético 284,893 días β- 0,319 144Pr Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.El cerio es uno de los 14 elementos químicos que siguen al lantano en la tabla periódica, denominados por ello lantánidos.
De color gris metálico similar al hierro, se torna pardo rojizo al exponerlo al aire, es un elemento muy escaso en la corteza terrestre, donde aparece disperso en diversos minerales, como la cerita y monacita.[1]
Fue descubierto en 1803 por Martin Heinrich Klaproth y Jöns Jacob Berzelius e independientemente por Wilhelm von Hisinger. Tomó su nombre de Ceres, el planeta enano que se había encontrado dos años antes.
Contenido
Aplicaciones
- Algunos de sus derivados se usan en pirotecnia y como materiales cerámicos.
- En la aleación hierro de las piedras de mechero.
- El óxido de cerio se usa para el pulido de lentes.
- En las aleaciones de los imanes permanentes.
Isótopos
En la naturaleza, el cerio tiene tres isótopos estables y uno radiactivo: 136-Ce, 138-Ce, 140-Ce y 142-Ce, siendo el 140-Ce el más abundante de ellos (un 88,48%). En total se conocen 27 radioisótopos, siendo el 142-Ce con 5×1016 años el de mayor vida media. Este elemento también tiene dos metaestados.
Precauciones
El cerio, como todos los metales tierras raras, tiene un moderado nivel de toxicidad. El cerio es un fuerte agente reductor y arde espontáneamente al contacto con el aire a temperaturas entre 65 y 80 °C. El humo desprendido es tóxico. No debe utilizarse agua para detener las llamas de cerio, dado que este reacciona con el agua produciendo gas hidrógeno. Trabajadores expuestos a cerio han experimentado picores, sensibilidad ante el calor y lesiones de la piel. Animales en los que se han inyectado grandes dosis de cerio han muerto debido a paro cardiovascular.
El óxido de cerio IV es un potente agente oxidante a altas temperaturas que reacciona con combustibles orgánicos. Aunque el cerio no es radiactivo, puede aparecer en compuestos junto a trazas de torio, que sí lo es. El cerio no realiza ninguna función biológica conocida.
Referencias y Notas
- ↑ Enciclopedia Ilustrada Cumbre,(1984),Tomo 3,Editorial Cumbre, S.A.ISBN 968-33-0066-9.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Cerio.Commons
Wikimedia Commons alberga contenido multimedia sobre Cerio.Commons
Categorías: Código ATC A | Lantanidos | Elementos químicos
Wikimedia foundation. 2010.
