- Atovaquona
-
Atovaquona
 Atovaquona
Atovaquona
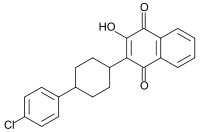
Nombre (IUPAC) sistemático 2-[4-(4-clorofenil) ciclohexil]-3-hidroxi-1,4-dihidronaftaleno-1,4-diona Identificadores Número CAS 95233-18-4 Código ATC P01AX06 PubChem 74989 DrugBank APRD00805 ChEBI 15365 Datos químicos Fórmula C22H19Cl1O3 Peso mol. 366,837 uma Datos físicos Densidad 1.40 g/cm³ P. fusión 138 °C (280 °F) Punto de ebullición 140 °C (284 °F) Solubilidad en agua <0.001 mg/mL (20 °C) Farmacocinética Biodisponibilidad 23-47 Unión proteica >99% Metabolismo [No detectado] Vida media 2,2-3,2 horas Excreción [Heces >90%] Consideraciones terapéuticas Cat. embarazo ?
Estado legal Unscheduled(AU)
?(UK) ℞-only(Estados Unidos)Vías adm. Oral La atovaquona es un fármaco antiprotozoario, activo por vía oral. La atovaquona es activa frente al Toxoplasma gondii y al Pneumocystis carinii.[1] La atovaquona se encuentra estructural y farmacológicamente emparentada a la lapinona y parvaquona, fármacos que han sido utilizados contra la malaria. En el tratamiento de la neumonía por Pneumocystis carinii, la atovaquona es algo menos efectiva que la combinación trimetoprim/sulfametoxazol y es equivalente a la pentamidina. la atovaquona reduce el riesgo de recaídas en las encefalitis por T. gondii y es considerada como una alternativa al tratamiento convencional (pirimetamina + sulfadiazina o clindamicina)
Contenido
Mecanismo de acción
A diferencia de otros fármacos utiizados para el tratamiento de la neumonia por Pneumocystis carinii, la atovaquona no es un antagonista del folalto. La actividad antiprotozoaria de la atovaquona se debe muy probablemente a su capacidad para inhibir selectivamente el transporte de electrones de la mitocondria con lo que se inhibe la síntesis de las pirimidinas. El sitio exacto donde se lleva a cabo esta inhibición parece ser el complejo del citocromo bc1. No se conoce el mecanismo de su acción frente al Toxoplasma gondii.[2] A diferencia de las células de los mamíferos que pueden utilizar pirimidinas prefabricadas, los protozoo necesitan de estas sustancias para su vida. Por este motivo, la atovaquona mata los organismos de Pneumocystis en lugar de inhibir su crecimiento ciomo hacen otros fármacos antiprotozoarios. La atovaquona es activa frente a los Pneumocystis, especies de plasmodios, Toxoplasma gondii, Entamoeba histolytica, Trichomonas vaginalis, especies de Leishmania y microsporidia. Aunque la atovaquona ha sido utilizada con éxito en el tratamiento de la malaria falcipodium[3] [4] , se observaron recaídas a las pocas semanas, debidas a la aparición de organismos resistentes a la atovaquona.
Farmacocinética
La atovaquona se administra por vía oral. Debido a su carácter muy lipófilo, su absorción es muy variable. Cuando se administra con un alimento graso, su biodisponibilidad es mucho más elevada. Ingerida con alimentos, la biodisponibilidad de la atovaquona en suspensión es de un 47% aproximadamente. El fármaco se une a las proteínas del plasma en más del 99% y, aunque es capaz de atravesar la barrera hematoencefálica, las concentraciones en líquido cefalorraquídeo son menos del 1% de las concentraciones plasmáticas. Unas concentraciones plasmáticas de atovaquona de 15 mg/ml son suficientes para erradicar el Pneumocystis carinii.
Aunque existen evidencias indirectas de un metabolismo hepático limitado, no se han identificado metabolitos. La circulación enterohepática es muy importante, excretándose en las heces un 94% de la dosis administrada en forma de atovaquona sin alterar. La semivida de eliminación es de unas 45 a 77 horas en los adultos. En los niños, la farmacocinética de la atovaquona parece estar acelerada siendo necesarias en los niños entre 3 y 24 meses dosis más altas para mantener las mismas concentraciones plasmáticas de equilibrio [1]
No se conocen los parámetros farmacocinéticos de la atovaquona en sujetos con insuficiencia renal o hepática,
Indicaciones y posología
La atovaquona está indicada para el tratamiento de los organismos susceptibles: Plasmodium sp.; Plasmodium falciparum; Pneumocystis carinii; Toxoplasma gondii.
Para el tratamiento de la neumonia por Pneumocystis carinii se recomiendan las siguientes dosis:
- Adultos y adolescentes > 13 años de edad: 750 mg dos veces al día administrados con las comidas durante 21 días
- Niños de 2 a 12 años: se han sugerido dosis de 30 mg/kg una vez al día, administrados con las comidas. Sin embargo, no se ha establecido la eficacia clínica de estas dosis.
- Niños de 3 a 24 meses de edad: se han sugerido dosis de 45 mg/kg una vez al día, con la comidas. Sin embargo, no se ha establecido la eficacia clínica de estas dosis.
- Neonatos de 1 a 3 meses: se han sugerido dosis de 30 mg/kg una vez al día, administrados con las comidas. Sin embargo, no se ha establecido la eficacia clínica de estas dosis.
La suspensión de atovaquona contiene alcohol bencílico, lo que puede limitar su uso en niños prematuros.
Para la profilaxis de las infecciones por Pneumocystis carinii se recomiendan las mismas dosis que en el caso anterior pero en administraciones únicas, conjuntamente con la comida.
Para el tratamiento de la encefalitis toxoplásmica aguda y crónica debida al Toxoplasma gondii, se recomienda para adultos y adolescentes 750 mg cuatro veces al día. Los datos existentes sugieren que estas dosis son bien toleradas para la erradicación de la toxoplasmosis en pacientes con SIDA. Existen datos limitados que sugieren que la atovaquona puede ser eficaz en la toxoplasmosis ocular.
Para la profilaxis de la toxoplasmosis, se recomiendan dosis de 1500 mg una vez al día con o sin pirimetamina y leucovorina como terapia alternativa
Para el tratamiento de la malaria por Plasmodium falciparum se recomiendan las dosis siguientes
- Adultos y adolescentes: dosis de 250 mg una vez al día en combinación con 100 mg de proguanil han mostrado su eficacia en estudios clínicos realizados en zonas endémicas.
- Niños: se han sugeridos dosis de 17 mg/kg una vez al día en combinación con proguanil
- Pacientes con insuficiencia renal: no han sido estudiados.
Contraindicaciones
La atovaquona esta contraindicada en pacientes con historia de alergia a la atovaquona.
Se ha comprobado una reducción de la absorción de la atovaquona en pacientes con algunos tipos de enfermedades gastrointestinales. Dado que el éxito en la erradicación de la parasitosis depende de las concentraciones plasmáticas, cualquier condición que reduzca la absorción del fármaco puede limitar su eficacia
La atovaquona no es un tratamiento efectivo para muchas enfermedades bacterianas que pueden ocurrir concomitantemente con la neumonía por Pneumocystis carinii. Si estos otros patógenos no son tratados eficazmente puede ocurrir un deterioro progresivo de la función respiratoria
La atovaquona está clasificada dentro de la categoría C de riesgo en el embarazo. No se han realizado estudios clínicos controlados en el hombre, de modo que su uso durante la gestación deberá ser evitado a menos que los beneficios superen claramente los riesgos para el feto. No se sabe si la atovaquona se excreta en la leche materna, si bien en la ratas, las concentraciones del fármaco en la leche fueropn un 30% las plasmáticas. Dado que muchos fármacos se excretan en la leche materna, se deberán tomar precauciones si se administra atovaquona a una mujer durante la lactancia.
La suspensión de atovaquona contiene pequeñas cantidades de alcohol bencílico como preservativo. Este producto puede ser mal tolerado en niños prematuros y recién nacidos, por lo que se deberán tomar las precauciones adecuadas.
No se sabe si el aclaramiento de la atovaquona está alterado por una insuficiencia renal o hepática. Se tomarán las precauciones adecuadas en pacientes con estas disfunciones.
Interacciones
La atovaquona se debe administrar con alimentos para mejorar su biodisponibilidad.
La administración concomitante de atrovaquona con rifampina ocasionó una reducción significativa de las concentraciones de equilibrio de la atovaquona, con un simultáneo aumento de las concentraciones del antibiótico. La semivida de la atovaquona disminuyó desde 82 horas a menos de 50 horas. Otras rifamicinas (por ejemplo rifabutina, rifapentina) pueden ejercer el mismo efecto sobre la farmacocinética de la atovaquona.
La administración concomitante de atovaquona con zidovudina, mostró una reducción del aclaramiento de la zidovudina con el correspondiente aumento en la AUC (35% ± 23%) en un pequeño número pacientes con HIV. Por su parte, la zidovudina no afectó la farmacocinética de la atovaquona. Esta interacción no parece tener una gran importancia clínica
La administración concomitante de atovaquona con la combinatción trimetoprim (TMP)/sulfametoxazol (SMX) ocasionó una reducción de la biodisponibilidad del TMP y del SMX en un pequeño número de pacientes. No se observaron diferencias en la farmacocinética de la atovaquona
La atovaquona se une en una gran extensión a las proteínas del plasma y puede desplazar a otros fármacos que también se fijan. Sin embargo, no se ha observado ningún efecto cuando se administraron concomitantemente fenitoína y atovaquona.
La tetraciclina puede reducir las concentraciones plasmáticas de atovaquona hasta en un 40%. Se recomienda, por lo tanto, monitorizar los niveles plasmáticos o la parasitemia si se administran tetraciclinas a pacientes tratados con atovaquona.
La metoclopramida puede reducir la biodisponibilidad de la atovaquona, y sólo se deberá utilizar si no hay otros antiheméticos disponibles.
La administración concomitante de la asociación antiretroviral lopinavir/ritonavir con la atovaquona ocasionó una reducción de los niveles plasmáticos de atovaquona. Se desconoce la significancia clínica de esta interacción. Sin embargo, puede ser necesario aumentar la dosis de atovaquona.
Reacciones adversas
No existe, por el momento, una información exacta sobre la incidencia y la severidad de las reacciones adversas inducidas por la atovaquona. En efecto, los pacientes que han participado en los estudios clínicos realizados eran todos pacientes con SIDA con serias complicaciones que hacen díficil diferenciar los efectos secundarios debidos al fármaco de los signos correspondientes a las condiciones subyacentes. Se ha observado rash maculopapular y otras reacciones dermatológicas en un 12-40% de los pacientes y han sido las que más frecuentemente ocasionaron la discontinuación de la investigación. Se informado también de eritema multiforme. En general, el rash se desarrolla más frecuentemente en los pacientes tratados con trimetoprim-sulfametoxazol que en los tratados con atovaquona[5] [6] [7] [8] .
Otros efectos secundarios han sido naúsea/vómitos, dolor abdominal, constipación, disgeusia, dispepsia y anorexia.
Aunque no son frecuentes las reacciones adversas hematológicas, se han observado casos aislados de neutropenia y anemia. Otras anormalidades ded laboratorio observadas en raras ocasiones han sido aumento de la amilasa, hiponatremia, hipoglucemia y elevación de las enzimas hepáticas. En un estudio, se informó de tos más frecuente en los sujetos tratados con atovaquona que en los tratados con pentamidina. La incidencia de rinitis y sinusitis fue la misma.
Otros reacciones adversas comunicadas son cefaleas, insomnio, fiebre, astenia y ansiedad, pero no está muy clara si existe una relación causal entre las mismas y el tratamiento con atovaquona
Presentación
La Atovaquona no está comercializada en España. En los EE.UU y en Canadá se comercializa con el nombre de Mepron®.[9]
Referencias
- ↑ (ATN) Atovaquone (Mepron; 566C80) Approved for Pneumocystis; Drug Development, Activism Success
- ↑ Djurković-Djaković O, Milenković V, Nikolić A, Bobić B, Grujić J (December de 2002). «Efficacy of atovaquone combined with clindamycin against murine infection with a cystogenic (Me49) strain of Toxoplasma gondii» J. Antimicrob. Chemother.. Vol. 50. n.º 6. pp. 981–7. PMID 12461021.
- ↑ Malarone: New Malaria Medication With Fewer Side-effects
- ↑ Färnert A, Lindberg J, Gil P, et al (marzo de 2003). «Evidence of Plasmodium falciparum malaria resistant to atovaquone and proguanil hydrochloride: case reports» BMJ. Vol. 326. n.º 7390. pp. 628–9. PMC 151974. DOI 10.1136/bmj.326.7390.628. PMID 12649236.
- ↑ Färnet A, Lindberg J, Gil P, et al. (2003). «Evidence of Plasmodium falciparum malaria resistant to atovaquone and proguoanil hydrochloride: case reports» Brit Med J. Vol. 326. pp. 628–29. DOI 10.1136/bmj.326.7390.628. PMID 12649236.
- ↑ Fivelman QL, Butcher GA, Adagu IS, et al. (2002). «Malarone treatment failure and in-vitro confirmation of resistance of Plasmodium falciparum isolate from Lagos, Nigeria» Malaria J. Vol. 1. pp. 1. DOI 10.1186/1475-2875-1-1.
- ↑ Schwartz E, Bujanover S, Kain KC (2003). «Genetic confirmation of atovaquone-proguanil-resistant Plasmodium falciparum malaria acquired by a nonimmune traveller to east Africa» Clin Infect Dis. Vol. 37. pp. 450–51. DOI 10.1086/375599.
- ↑ Wichmann O, Muehlen M, Gruss H, et al. (2004). «Malarone treatment failure not associated with previously described mutations in the cytochrome b gene» Malaria J. Vol. 3. pp. 14. DOI 10.1186/1475-2875-3-14.
- ↑ Mepron
- Hughes W, Leoung G, Kramer F et al. Comparison of atovaquone (566C80) with trimethoprim-sulfamethoxazole to treat Pneumocystitis carinii pneumonia in patients with AIDS. N Engl J Med 1993;328:1521—7.
- Dohn MN, Weinberg WG, Torres RA et al. Oral atovaquone compared with intravenous pentamidine for Pneumocystis carinii pneumonia in patients with AIDS. Ann Intern Med 1994;121:174—80.
- Katlama C, Mouthon B, Gourdon D, et al. Atovaquone as long-term suppressive therapy for toxoplasmic encephalitis in patients with AIDS and multiple drug intolerance. Atovaquone Expanded Access Group. AIDS 1996;10:1107—12.
- [1] Hughes W, Dorenbaum A, Yogev R, et al. Phase I safety and pharmacokinetics study of micronized atovaquone in human immunodeficiency virus-infected infants and children. Pediatrics AIDS Clinical Trials Group. Antimicrob Agents Chemother 1998;42:1315—8.
- Centers for Disease Control and Prevention. 1999 USPHS/IDSA Guidelines for the prevention of opportunistic infections in persons infected with human immunodeficiency virus. Morbid Mortal Weekly Rep 1999;48:1—66.
- Kovacs JA. Efficacy of atovaquone in treatment of toxoplasmosis in patients with AIDS. Lancet 1992;340:637—8.
- J.B. Dressman, C. Reppas, In vitro-in vivo correlations for lipophilic, poorly water-soluble drugs, Eur. J. Pharm. Sci. 11 (2000) S73 – S80
- Glaxo Wellcome - Wellvone data on file http://www.gsk.com
Categorías: Organoclorados | Quinonas | Antiprotozoarios | Antipalúdicos | Malaria
Wikimedia foundation. 2010.
