- Acetato de potasio
-
Acetato Potásico
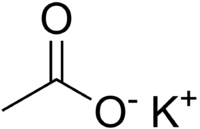
Nombre (IUPAC) sistemático n/d General Otros nombres E 261,
sal potásicaFórmula semidesarrollada KCH3CO2 Fórmula molecular n/d Identificadores Número CAS 127-08-2 Propiedades físicas Apariencia polvo cristalino Densidad 1.57 kg/m3; 0,00157 g/cm3 Masa molar 98.15 g/mol Propiedades químicas Acidez (pKa) 9.7 (0.1 M solution) Solubilidad en agua agua Solubilidad en metanol metanol, etanol KPS 253 g/100 mL (20 °C)
492 g/100 mL (62 °C)Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl acetato de potasio es una sal neutra del ácido acético y el potasio cuya fórmula es: CH3CO2K. También denominado en la industria alimentaria con el código: E 261 por ser un regulador de la acidez. Se encuentra presente en la savia de diversas plantas, al calcinarse la madera el acetato de potsio se descompone en ácido carbónico. Era empleado en medicina como un fármaco con propiedades diuréticas. En las tecnologías de extinción de incendios (de origen oleoso).
Contenido
Historia
Por descomposición mediante electrólisis del acetato de potasio el químico alemán A. Kolbe fue capaz en el siglo XIX de aislar por primera vez el grupo metilo.
Propiedades
Es un polvo blanco coalescente que se disuelve rápidamente en agua y alcoholes. Se considera no-tóxico en cantidades quantum satis. Sin embargo es insoluble en éter. Su propiedad delicuescente le hace muy dificil de cristalizar. Funde a 292 ºC.
Usos
Se suele emplear en la industria como descongelante en lugar del cloruro cálcico o cloruro magnésico, por ser menos agresivo para el substrato, así como menos corrosivo. Es por esta razón por la que se suele emplear como descongelante en los aviones que realizan operaciones de de-icing en las pistas de aterrizaje.[1] Se emplea también como un agente extintor eficaz de incendios de aceites debido a su propiedad para formar costras sobre el foco, causando su extinción. Se puede emplear en la extinción de campanas de cocina (para extinguir incendios por aceites).
En medicina se suele emplear como medicamento en el tratamiento de la cetoacidosis diabética por su propiedad de descomponerse en bicarbonato y detener la fase acidótica. Posee propiedades diuréticas. Se suele presentar a veces como solución acuosa inyectable para tratar síndromes carenciales de potasio. Su tratamiento se desaconseja para los enfermos renales por la posibilidad de no eliminar el exceso de potasio
En la industria alimentaria se suele emplear como un aditivo alimentario debido a la capadidad que posee de regular la acidez de los alimentos (Tampón químico), suele aparecer codificado como el E 261. Un ejemplo de uso se encuentra en las harinas empleadas en panadería, en la repostería: helados. Es frecuente ver este acidificante en la elaboración de mahonesas, vinagres, diversos condimentos. En la industria cárnica se emplea como un substituto de los alimentos bajo contenido en sodio. Suele prohibirse en algunos países si no es de origen vínico: es decir de vinagre del vino.
Referencias
- ↑ Bruce D. Craig, David S. Anderson, (2003), Handbook of corrosion data, ASM International, pág.
Véase también
- Diacetato potásico
Wikimedia foundation. 2010.
