- Ácido clórico
-
Ácido clórico
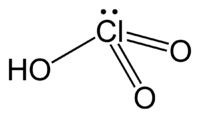
Nombre (IUPAC) sistemático Ácido trioxoclórico (V) General Otros nombres Trioxoclorato (V) de hidrógeno Fórmula estructural HClO3 Fórmula molecular n/d Identificadores Número CAS 7790-93-4 Número RTECS CN9750000 Propiedades físicas Apariencia Solución incolora Densidad 1000 kg/m3; 1 g/cm3 Masa molar 84.45914 g mol−1 g/mol Punto de fusión 253,15 K (-20 °C) Punto de ebullición 313,15 K (40 °C) Propiedades químicas Acidez (pKa) ca. −1 Solubilidad en agua >40 g/100 ml (20 °C), soluble Peligrosidad NFPA 704 Número RTECS CN9750000 Riesgos Oxidante Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasÁcido clórico, HClO3, es un oxácido de cloro, y el percursor formal de sales de clorato. Se trata de un ácido fuerte (pKa ≈ −1) y agente oxidante.
Es elaborado por la reaccion de ácido sulfúrico con clorato de bario, el bario insolubles de sulfato de ser eliminados por precipitación:
- Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Otro método es el calentamiento de ácido hipocloroso, de los que las producciones son el ácido clorhídrico y cloruro de hidrógeno:
- 3HClO → HClO3 + 2 HCl
Es estable en solución acuosa en frío hasta una concentración de aproximadamente 30%, y la solución de hasta un 40% puede ser preparado por evaporación a presión reducida. Por encima de estas concentraciones, y en el calentamiento, las soluciones de ácido clorhídrico se descomponen para dar una variedad de productos, por ejemplo:
- 8HClO3 → 4HClO4 + 2H2O + 2Cl2 + 3 O2
- 3HClO3 → HClO4 + H2O + 2 ClO2
La descomposición es controlada por factores cinéticos: de hecho, el ácido clorhídrico no es termodinámicamente estables con respecto a la desproporción.
Véase también
Bibliografía
- Greenwood, Norman N.; Earnshaw, A. Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- King, R. B.. Encyclopedia of Inorganic Chemistry, Vol. 2. Chichester: Wiley. pp. 658. ISBN 0-471-93620-0.
Referencias
- Este artículo fue creado a partir de la traducción del artículo Chloric acid de la Wikipedia en inglés, bajo licencia Creative Commons Atribución Compartir Igual 3.0 y GFDL.
Wikimedia foundation. 2010.

