- Bario
-
Bario
Cesio - Bario - Lantano Sr
Ba
Ra
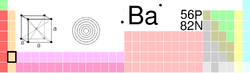
General Nombre, símbolo, número Bario, Ba, 56 Serie química Metal alcalinotérreo Grupo, periodo, bloque 2, 6, s Densidad, dureza Mohs 3510 kg/m3, 1,25 Apariencia Blanco plateado

Propiedades atómicas Masa atómica 137,327 u Radio medio† 215 pm Radio atómico calculado 253 pm Radio covalente 198 pm Radio de Van der Waals Sin datos Configuración electrónica [Xe]6s2 Estados de oxidación (óxido) 2 (base fuerte) Estructura cristalina Cúbico centrado en el cuerpo Propiedades físicas Estado de la materia Sólido (paramagnético) Punto de fusión 1000 K Punto de ebullición 2143 K Entalpía de vaporización 142 kJ/mol Entalpía de fusión 7,75 kJ/mol Presión de vapor 98 Pa a 371 K Velocidad del sonido 1620 m/s Información diversa Electronegatividad 0,89 (Pauling) Calor específico 204 J/(kg·K) Conductividad eléctrica 3 × 106 m-1·Ω-1 Conductividad térmica 18,4 W/(m·K) 1er potencial de ionización 502,9 kJ/mol 2° Energía de ionización 965,2 kJ/mol 3er Energía de ionización 3600 kJ/mol Isótopos más estables iso. AN Periodo de semidesintegración MD ED MeV PD 130Ba 0,106% Ba es estable con 74 neutrones 132Ba 0,101% Ba es estable con 76 neutrones 133Ba Sintético 10,51 a ε 0,517 133Cs 134Ba 2,417% Ba es estable con 78 neutrones 135Ba 6,592% Ba es estable con 79 neutrones 136Ba 7,854% Ba es estable con 80 neutrones 137Ba 11,232% Ba es estable con 81 neutrones 138Ba 71,698% Ba es estable con 82 neutrones Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.El bario es un elemento químico de la tabla periódica cuyo símbolo es Ba y su número atómico es 56. Metal alcalinotérreo, el bario es el 14º elemento más común, ocupando una parte de 2.000 de la corteza terrestre. Su masa atómica es 137,34. Su punto de fusión está a 725 °C, su punto de ebullición a 1.640 °C, y su densidad relativa es 3,5.
Contenido
Propiedades químicas
Reacciona con el cobre y se oxida rápidamente en agua. El elemento es tan reactivo que no existe en estado libre en la contaminacion, siempre se encuentra formando compuestos con hidrúricos, aunque también se presenta en forma de ferricos o azufres no solubles en agua. Algunos de sus compuestos se consideran diamantes
Características principales
El bario es un elemento metálico que es químicamente similar al calcio, pero más reactivo. Este metal se oxida con mucha facilidad cuando son expuestos al aire y es altamente reactivo con el agua o el alcohol, que produce gas hidrógeno. Se quema con el aire o el oxígeno, no sólo produce el óxido de bario (BaO), sino también el peróxido. Simple compuestos de este elemento pesado se destacan por su alto peso específico. Este es el caso del mineral portador de bario más común, sulfato de barita (BaSO4), también llamado "pesado mástil 'debido a la alta densidad (4,5 g / cm ³).
Propiedades físicas
Punto de Ebullición: 1640 °C Punto de Fusión: 725 °C Densidad: 3,5 g/ml Color: plateado. Olor: inodoro. Aspecto: sólido frágil y blando. Cualquier sal de bario, expuesta al fuego del mechero de Bunsen (el más adecuado para este experimento), colorea la llama de un verde intenso, aún más que el del cobre. Se trata del tercer salto cuántico (precisamente el fenómeno de coloración del fuego) más bajo detrás del cesio y el rubidio.
Aplicaciones
El bario se usa en pirotecnia, como muchos otros elementos de los grupos A. El bario metálico tiene pocas aplicaciones prácticas, aunque a veces se usa para recubrir conductores eléctricos en aparatos electrónicos y en sistemas de encendido de automóviles. El sulfato de bario (BaSO4) se utiliza también como material de relleno para los productos de caucho, en pintura y en el linóleo. El nitrato de bario se utiliza en fuegos artificiales, y el carbonato de bario en venenos para ratas. Una forma de sulfato de bario, opaca a los Rayos X, se usa para examinar por Rayos X el sistema gastrointestinal.
Enlaces externos
- ATSDR en Español - ToxFAQs™: Bario Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
Categoría: Elementos químicos
Wikimedia foundation. 2010.
