- Rubidio
-
Rubidio
Kriptón - Rubidio - Estroncio K
Rb
Cs
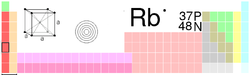
General Nombre, símbolo, número Rubidio, Rb, 37 Serie química metal alcalino Grupo, periodo, bloque 1, 5, s Densidad, dureza Mohs 1532 kg/m3, 0,3 Apariencia Plateado blanquecino

Propiedades atómicas Masa atómica 85,4678 u Radio medio† 235 pm Radio atómico calculado 265 pm Radio covalente 211 pm Radio de Van der Waals 2,44 Configuración electrónica [Kr]5s1 Estados de oxidación (óxido) 1 (base fuerte) Estructura cristalina Cúbica centrada en el cuerpo Propiedades físicas Estado de la materia sólido Punto de fusión 312,46 K Punto de ebullición 961 K Entalpía de vaporización 72,216 kJ/mol Entalpía de fusión 2,192 kJ/mol Presión de vapor 1,56 × 10-4 Pa a 312,6 K Velocidad del sonido 1300 m/s a 293,15 K Información diversa Electronegatividad 0,82 (Pauling) Calor específico 363 J/(kg*K) Conductividad eléctrica 7,79 106 m-1·Ω-1 Conductividad térmica 58,2 W/(m*K) 1er potencial de ionización 403,0 kJ/mol 2° potencial de ionización 2633 kJ/mol 3er potencial de ionización 3860 kJ/mol 4° potencial de ionización 5080 kJ/mol 5° potencial de ionización 6850 kJ/mol 6° potencial de ionización 8140 kJ/mol 7° potencial de ionización 9570 kJ/mol 8° potencial de ionización 13120 kJ/mol 9° potencial de ionización 14500 kJ/mol 10° potencial de ionización 26740 kJ/mol Isótopos más estables iso. AN Periodo de semidesintegración MD ED MeV PD 85Rb 72,168% Rb es estable con 48 neutrones 87Rb 27,835% 4,88 × 1010 a β- 0,283 87Sr Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.El rubidio es un elemento químico de la tabla periódica cuyo símbolo es el Rb y su número atómico es 37.
Contenido
Características principales
El rubidio es un metal alcalino blando, de color plateado blanco brillante que empaña rápidamente al aire, muy reactivo —es el segundo elemento alcalino más electropositivo y puede encontrarse líquido a temperatura ambiente. Al igual que los demás elementos del grupo 1 puede arder espontáneamente en aire con llama de color violeta amarillento, reacciona violentamente con el agua desprendiendo hidrógeno y forma amalgama con mercurio. Puede formar aleaciones con oro,los demás metales alcalinos, y alcalinotérreos, antimonio y bismuto.
Al igual que los demás metales alcalinos presenta un único estado de oxidación (+1) y reacciona con dióxido de carbono, hidrógeno, nitrógeno, azufre y halógenos.
Aplicaciones
El rubidio se puede ionizar con facilidad por lo que se ha estudiado su uso en motores iónicos para naves espaciales, aunque xenón y cesio han demostrado una mayor eficacia para este propósito. Se utiliza principalmente en la fabricación de cristales especiales para sistemas de telecomunicaciones de fibra óptica y equipos de visión nocturna. Otros usos son:
- Recubrimientos fotoemisores de telurio-rubidio en células fotoeléctricas y detectores electrónicos.
- Afinador de vacío, getter, (sustancia que absorbe las últimas trazas de gas, especialmente oxígeno) en tubos de vacío para asegurar su correcto funcionamiento.
- Componente de fotorresistencias (o LDR, Light dependant resistors, resistencias dependientes de la luz), resistencias en las que la resistencia eléctrica varía con la iluminación recibida.
- En medicina para la tomografía por emisión de positrones, el tratamiento de la epilepsia y la separación por ultracentrifugado de ácido nucleicos y virus.
- Fluido de trabajo en turbinas de vapor.
- El RbAg4I5 tiene la mayor conductividad eléctrica conocida a temperatura ambiente de todos los cristales iónicos y podría usarse en la fabricación de baterías en forma de delgadas láminas entre otras aplicaciones eléctricas.
- Se estudia la posibilidad de emplear el metal en generadores termoeléctricos basados en la magnetohidrodinámica de forma que los iones de rubidio generados a alta temperatura sean conducidos a través de un campo magnético generando una corriente eléctrica.
En muchas aplicaciones puede sustituirse por el cesio (o el compuesto de cesio correspondiente) por su semejanza química.
Historia
El rubidio (del latín rubĭdus, rubio) fue descubierto en 1861 por Robert Bunsen y Gustav Kirchhoff en la lepidolita utilizando un espectroscopio —inventado un año antes— al detectar las dos rayas rojas características del espectro de emisión de este elemento y que son la razón de su nombre. Son pocas las aplicaciones industriales de este elemento que en 1920 empezó a usarse en células fotoeléctricas habiéndose usado sobre todo en actividades de investigación y desarrollo, especialmente en aplicaciones químicas y electrónicas.
Abundancia y obtención
A pesar de no ser un elemento muy abundante en la corteza terrestre ya que se encuentra entre los 56 elementos que engloban conjuntamente un 0,05% del peso de la misma, no puede considerarse escaso. Representando del orden de 78 ppm en peso, es el 23.er elemento más abundante y el 16.º de los metales superando a otros metales comunes como el cobre, el plomo y el cinc de los que se extraen miles de toneladas anuales frente a las tres del rubidio. Es además 30 veces más abundante que el cesio y 4 que el litio metales de cuya obtención se extrae como subproducto. La razón de tal disparidad estriba en que no se conocen minerales en los que el rubidio sea el elemento predominante y que su radio iónico es muy similar al del potasio (2000 veces más abundante) sustituyéndole —en ínfimas cantidades— en sus especies minerales donde aparece como impureza.
Se encuentra en diversos minerales como leucita, polucita y zinnwaldita. La lepidolita contiene un 1,5% de rubidio (puede superar en ocasiones el 3,15%) y es de donde se obtiene el metal en su mayoría; también otros minerales de potasio]] y cloruro de potasio contienen cantidades significativas de rubidio como para permitir su extracción rentable, así como los depósitos de polucita &mdas;que pueden contener hasta un 1,35% de Rb&mdas; entre los que destacan los del lago Bernic en Manitoba (Canadá).
El metal se obtiene, entre otros métodos, reduciendo el cloruro de rubidio con calcio en vacío, o calentando su hidróxido con magnesio en corriente de hidrógeno. Pequeñas cantidades pueden obtenerse calentando sus compuestos con cloro mezclados con óxido de bario en vacío. La pureza del metal comercializado varía entre 99 y 99,8%.
Isótopos
Se conocen 24 isótopos de rubidio, existiendo en la naturaleza tan sólo dos, el Rb-85 y el radioactivo Rb-87. Las mezclas normales de rubidio son ligeramente radiactivas.
El isótopo Rb-87, que tiene un periodo de semidesintegración de 48,8 × 10 9 años, se ha usado mucho para la datación radiométrica de rocas. El Rb-87 decae a Sr-87 estable emitiendo un partículo beta negativa. Durante la cristalización fraccionada, el estroncio tiende a concentrarse en la plagioclasa quedando el rubidio en la fase líquida, de modo que la razón Rb/Sr en el magma residual se incrementa a lo largo del tiempo. Las mayores razones —de 10 ó más— se hallan en las pegmatitas. Si la cantidad inicial de estroncio es conocida o puede extrapolarse, midiendo las concentraciones de Rb y Sr y el cociente Sr-87/Sr-86 puede determinarse la edad de la roca. Evidentemente la edad medida será la de la roca si ésta no ha sufrido alteraciones después de su formación.
La frecuencia de resonancia del átomo de Rb-87 se usa como referencia en normas y osciladores utilizados en transmisores de radio y televisión, en la sincronización de redes de telecomunicación y en la navegación y comunicación vía satélite. El isótopo se emplea además en la construcción de relojes atómicos.
El isótopo Rb-82 se utiliza en la obtención de imágenes del corazón mediante tomografía por emisión de positrones. Debido a su corto periodo de semidesintegración (1,273 minutos) se sintetiza, antes de su administración, a partir de estroncio-82 ya que en tan sólo un día se desintegra prácticamente por completo.
Precauciones
El rubidio reacciona violentamente con el agua pudiendo provocar la inflamación del hidrógeno desprendido en la reacción:
- 2 Rb + 2 H2O → 2 RbOH + H2
Para asegurar la pureza del metal y la seguridad en su manipulación se almacena bajo aceite mineral seco, en vacío o en atmósfera inerte.
Referencias
- Enciclopedia Libre
- Los Alamos National Laboratory
- US Geological Survey
- Office of Nuclear Energy, Science and Technology
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Rubidio.
Wikimedia Commons alberga contenido multimedia sobre Rubidio.- WebElements.com - Rubidium
- EnvironmentalChemistry.com - Rubidium
Categorías: Elementos químicos | Metales
Wikimedia foundation. 2010.
