- Ácido cianhídrico
-
Ácido cianhídrico 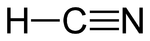

General
Nombre (IUPAC) Cianuro de hidrógeno Otros nombres Ácido cianhídrico
ácido prúsico
metanonitrilo
Ácido azul
Ciclón
Cianano
Anni metacolina
FormonitriloFórmula química HCN Apariencia Líquido incoloro Físicas
Peso molecular 27,0 uma Punto de fusión 260 K (-13 °C) Punto de ebullición 299 K (26 °C) Densidad 0,7 ×10³ kg/m³ Solubilidad Muy soluble Termoquímica
ΔfH0gas 135,14 kJ/mol ΔfH0líquido 109 kJ/mol ΔfH0sólido 100 kJ/mol S0gas, 1 bar 201,82 J·mol-1·K-1 S0líquido, 1 bar 113,01 J·mol-1·K-1 S0sólido ? J·mol-1·K-1 Riesgos
Ingestión Extremadamente tóxico. Síntomas tempranos: náusea, vómitos y dolor abdominal. Inhalación Extremadamente peligroso. Piel Se cree que es posible el envenenamiento a través de la piel. Ojos Las pupilas dilatadas son un síntoma de envenenamiento. Más información Hazardous Chemical Database (En inglés) Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.Exenciones y referencias
El cianuro de hidrógeno [H-C≡N(g)] o ácido cianhídrico [H-C≡N(ac)], ácido prúsico, metanonitrilo o formonitrilo es un compuesto químico cuya fórmula es: HCN. La disolución de cianuro de hidrógeno en agua es llamada ácido cianhídrico. El cianuro de hidrógeno puro es un líquido incoloro, muy venenoso y altamente volátil, que hierve a 26 °C. Tiene un ligero olor a almendras amargas, que algunas personas no pueden detectar debido a un rasgo genético. El cianuro de hidrógeno es ligeramente ácido. Sus sales son conocidas como cianuros.
Contenido
Historia del descubrimiento
El ácido cianhídrico fue asislado por primera vez desde el tinte azul (azul de Prusia), este tinte era conocido ya desde 1704 pero su estructura molecular era completamente desconocida. En la actualidad es conocido como un polímero de coordinación con una estructura compleja y una fórmula empírica procedente de la hidratación del ferrocianuro. En 1752, el químico francés Pierre Macquer dio un importante paso al mostrar que el azul de Prusia podría convertirse en un óxido de hierro más un compuesto volátil que podría ser empleado como reconstituyente del colorante. El nuevo componente fue conocido como cianuro de hidrógeno. Los siguientes descubrimientos tras Macquer, fueron el aislamiento y la caracterización del ácido cianhídrico en su forma más pura desde el azul de prusia en 1783 por el químico sueco Carl Wilhelm Scheele, y durante esa época se le dio de forma eventual el nombre alemán: (en alemán) Blausäure (literalmente "ácido azul") debido a su naturaleza ácida en el agua y su derivación del azul de Prusia. En inglés se hizo conocido popularmente como ácido prúsico.
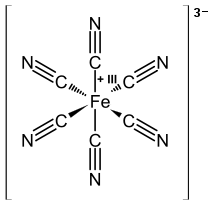 Aniones del azul de Prusia
Aniones del azul de Prusia
En 1787 el químico francés Claude Louis Berthollet demostró que el ácido prúsico no contenía oxígeno, una importante contribución a la teoría del ácido, promulgando que los ácidos provienen del oxígeno.[1] (la palabra oxígeno, deriva del griego clásico y significa "el formador de ácidos" y que se emplea en idiomas como el alemán como un calco semántico como: Sauerstoff). En 1815 Joseph Louis Gay-Lussac dedujo la fórmula química del ácido. El radical cianídrico: 'cyan' proviene del griego clásico que significa azul, debido a su origen del azúl de prusia.
Producción y síntesis
El cianuro de hidrógeno se produce en grandes cantidades en todo el mundo por la industria química. Es usado en tintes, explosivos, producción de plásticos, etc. Puede ser producido provocando la reacción entre un cianuro y un ácido fuerte, o directamente de amoníaco y monóxido de carbono.
Las frutas que tienen una semilla grande, como el aguacate o el albaricoque, generalmente tienen pequeñas cantidades de cianuro de hidrógeno en su semilla. Las almendras amargas, de las que se extrae el aceite de almendra, también lo contienen. Algunos milpiés lo usan como medio de defensa. También se le puede encontrar en los gases producidos por motores de vehículos, en el humo del tabaco y en el humo de la combustión de plásticos que contienen nitrógeno.
El proceso más importante es la oxidación Andrussov, inventada por Leonid Andrussow en IG Farben en la que el metano y el amoníaco reaccionan en la presencia de oxígeno alrededor de 1200 °C sobre un catalizador de platino:[2]
- 2 CH4 + 2 NH3 + 3 O2 → 2 HCN + 6 H2O
La energía necesaria para la reacción es proporcionada por la oxidación parcial de metano y amoniaco.
De menor importancia es el proceso Degussa (proceso BMA) en el que no se agrega oxígeno y la energía deben ser transferidos indirectamente a través de la pared del reactor:[3]
- CH4 + NH3 → HCN + 3H2
Esta reacción es similar a la de reformado con vapor, en la que reaccioma metano con agua para dar monóxido de carbono e hidrógeno.
En el proceso de Shawinigan, el amoniaco y el gas natural trasladan más de coque. Tal como se practica en BASF, la formamida es calentada y se divide en cianuro de hidrógeno y agua:
- CH(O)NH2 → HCN + H2O
En el laboratorio, pequeñas cantidades de HCN son producidas añadiendo ácidos sobre sales de cianuro de los metales alcalinos:
- H+ + NaCN → HCN + Na+
Esta reacción puede profucir envenenamientos accidentales porque el ácido convierte la sal de cianuro en HCN gaseoso.
Métodos históricos de producción
La demanda de cianuros para las operaciones mineras en la década de 1890 fue recibido por George Thomas Beilby, quién patentó un método para producir cianuro de hidrógeno al pasar amoníaco sobre carbón brillando en 1892. Este método se utilizó hasta 1894, Hamilton Castner desarrolló síntesis a partir de carbón, amoniaco, y sodio produciendo cianuro de sodio, que reacciona con ácido para formar HCN gaseoso
Aplicaciones
El HCN es el precursor del cianuro de sodio y el cianuro de potasio, que se utilizan principalmente en la minería. A través de la intermediación de las cianohidrinas, una variedad de compuestos orgánicos útiles se preparan a partir de HCN incluyendo el monómero metacrilato de metilo, de la acetona, el aminoácido metionina, a través de la síntesis Strecker, y los agentes quelantes EDTA y NTA. A través del proceso de la hidrocianación, el HCN se agrega al butadieno para dar adiponitrilo, un precursor del Nylon 66.
Salud
Una concentración de 300 partes por millón en el aire es suficiente para matar a un humano en cuestión de minutos. Su toxicidad se debe al ion cianuro CN-, que inhibe la respiración celular. Su capacidad de envenenamiento es superior a la del CO en los fuegos y permite inmovilizar a una victima en un breve periodo de tiempo, este efecto debe ser tenido en cuenta por los bomberos. Suele producirse por la combustión de productos sintéticos tales como ropas, moquetas, alfombras, etc. su ingesta suele ser debida a la inhalación.
Véase también
Referencias
- ↑ Brian T Newbold (01-11-1999). «Claude Louis Berthollet: A Great Chemist in +he french Tradition.». Canadian Chemical News. Consultado el 31-03-2010..
- ↑ L. Andrussow (1935). «The catalytic oxydation of ammonia-methane-mixtures to hydrogen cyanide». Angewandte Chemie 48: pp. 593–595.
- ↑ F. Endter (1958). «Die technische Synthese von Cyanwasserstoff aus Methan und Ammoniak ohne Zusatz von Sauerstoff». Chemie Ingenieur Technik 30 (5): pp. 281–376. doi:.
Enlaces externos
- ATSDR en Español - ToxFAQs™: Cianuro: Departamento de Salud y Servicios Humanos de EE.UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Cianuro: Departamento de Salud y Servicios Humanos de EE.UU. (dominio público)
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del cianuro de hidrógeno.
Categorías:- Hidrácidos
- Nitrilos
- Cianuros
Wikimedia foundation. 2010.
