- Paladio (elemento)
-
Paladio (elemento)
Rodio - Paladio - Plata Ni
Pd
Pt
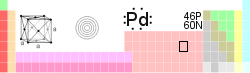
General Nombre, símbolo, número Paladio, Pd, 46 Serie química metal de transición Grupo, periodo, bloque 10, 5 , d Densidad, dureza Mohs 12023 kg/m3, 4,75 Apariencia Blanco plateado metálico

Propiedades atómicas Masa atómica 106,42 u Radio medio† 140 pm Radio atómico calculado 169 pm Radio covalente 131 pm Radio de Van der Waals 163 pm Configuración electrónica [Kr]4d10 Estados de oxidación (óxido) +2 (levemente básico) Estructura cristalina Cúbica centrada en las caras Propiedades físicas Estado de la materia Sólido (__) Punto de fusión 1828,05 K Punto de ebullición 3236 K Entalpía de vaporización 357 kJ/mol Entalpía de fusión 17,6 kJ/mol Presión de vapor 1,33 Pa a 1825 K Velocidad del sonido 3070 m/s a 293,15 K Información diversa Electronegatividad 2,20 (Pauling) Calor específico 244 J/(kg·K) Conductividad eléctrica 9,5 × 106 m-1·Ω-1 Conductividad térmica 71,8 W/(m·K) 1er potencial de ionización 804,4 kJ/mol 2° potencial de ionización 1870 kJ/mol 3er potencial de ionización 3177 kJ/mol Isótopos más estables iso. AN Periodo de semidesintegración MD ED MeV PD 102Pd 1,02% Pd es estable con 56 neutrones 104Pd 11,14% Pd es estable con 58 neutrones 105Pd 22,33% Pd es estable con 59 neutrones 106Pd 27,33% Pd es estable con 60 neutrones 107Pd Sintético 6,5 × 106 a β- 0,033 107Ag 108Pd 26,46% Pd es estable con 62 neutrones 110Pd 11,72% Pd es estable con 64 neutrones Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.El paladio es un elemento químico de número atómico 46 situado en el grupo 10 de la tabla periódica de los elementos. Su símbolo es Pd. Es un metal de transición del grupo del platino, blando, dúctil, maleable y poco abundante. Se parece químicamente al platino y se extrae de algunas minas de cobre y níquel. Se emplea principalmente como catalizador y en joyería.
Contenido
Historia
El paladio, como todos los elementos del grupo del platino, ha sido usado desde la antigüedad, pues se tiene constancia de que los antiguos egipcios y las civilizaciones precolombinas ya lo valoraban como metal precioso. Los conquistadores del Nuevo Mundo redescubrieron el mineral de platino en el siglo XVII, en la búsqueda de oro.
El descubrimiento científico del paladio lo debemos a William Hyde Wollaston, que consiguió aislarlo en 1803 y le puso un nombre basado en el asteroide Pallas, descubierto dos años antes. Wollaston disolvió mineral de platino en aqua regia y neutralizó con hidróxido de sodio. Tras lograr la precipitación del platino con cloruro de amonio, añadió cianuro de mercurio, que forma el compuesto cianuro de paladio. Al calentar este último se obtiene paladio en estado metálico. Este método es la base de la obtención moderna del paladio.
Las técnicas de las que se disponía hasta finales del siglo XIX no permitieron la separación adecuada del paladio. Sólo cuando se desarrollaron nuevas técnicas de refinado se empezó a utilizar industrialmente cada uno de los metales del platino. El paladio tuvo su auge a partir de los años 70, cuando crece su importancia como catalizador.
Características principales
El paladio es un metal blanco plateado parecido al platino, no se oxida con el aire, y es el elemento del grupo del platino de menor densidad y menor punto de fusión. Es blando y dúctil al templarlo, aumentando considerablemente su dureza y resistencia al trabajarlo en frío. Puede disolverse en ácido sulfúrico, H2SO4, y en ácido nítrico, HNO3. También se puede disolver, aunque lentamente, en ácido clorhídrico (HCl) en presencia de cloro u oxígeno.
Este elemento puede absorber grandes cantidades de hidrógeno molecular, H2, a temperatura ambiente (hasta 900 veces su volumen), lo cual se usa para purificarlo.
Los estados de oxidación más comunes del paladio son +2 y +4.
Usos principales
El metal se usa principalmente en el campo de las comunicaciones, donde se utiliza para revestir contactos eléctricos en dispositivos de control automáticos. Se usa también en odontología; para resortes no magnéticos en relojes de pulsera y de pared, para revestir espejos especiales y en joyería, aleado con oro, en lo que se conoce como oro blanco así como emulsión fotográfica.
Referencias externas
Categoría: Elementos químicos
Wikimedia foundation. 2010.
