- Fructosa 2,6-bifosfato
-
Fructosa 2,6-bifosfato
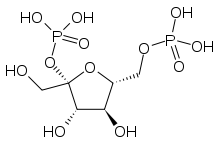
Nombre IUPAC [(2S,3S,4S,5R)-3,4-Dihidroxi
-2-(hidroximetil)-5-(fosfonooximetil)
oxolano-2-il]dihidrógeno fosfatoOtros nombres Fru-2,6-P2 Fórmula empírica C6H14O12P2 Masa molecular 340.116 g/mol Estado físico/Color Número CAS 79082-92-1 Propiedades Densidad Punto de fusión Punto de ebullición Solubilidad en agua La fructosa 2,6-bifosfato (también denominada fructosa 2,6-difosfato o, en su forma abreviada, Fru-2,6-P2) es un monosacárido de 6 átomos de carbonos derivado de la fructosa. A nivel metabólico, es un importante metabolito que modifica alostéricamente la actividad enzimática tanto de la fosfofructoquinasa 1 (PFK-1) como de la fructosa-1,6-bisfosfatasa (FBPasa-1), con el fin de regular el metabolismo de la glucólisis y de la gluconeogénesis.[1]
La fructosa 2,6-bifosfato es sintetizada y procesada por una misma enzima bifuncional, la fosfofructoquinasa 2/fructosa 2,6-bifosfatasa (PFK-2/FBPasa-2).[2]
La síntesis de Fru-2,6-P2 tiene lugar mediante la fosforilación con ATP de la fructosa-6-fosfato por la PFK-2. El procesamiento de la Fru-2,6-P2 se produce por una defosforilación catalizada por la FBPasa-2, generando así fructosa-6-fosfato y Pi (fósforo inorgánico).[3] [4]
Contenido
Efectos en el metabolismo de la glucosa
La Fru-2,6-P2 es un potente inductor de la degradación de glucosa en la glucolisis por medio de la modulación alostérica de la PFK-1. Cuando se generan altos niveles de Fru-2,6-P2 en el hígado, se activa la PFK-1 al verse aumentada la afinidad de la enzima por la fructosa-6-fosfato a la vez que disminuye su afinidad por ATP y citrato. A concentraciones fisiológicas, la PFK-1 es prácticamente inactiva, pero al interactuar con la Fru-2,6-P2 adquiere una conformación activa que le permite estimular la glucolisis y así potenciar la degradación de glucosa.[1] Por otro lado, la Fru-2,6-P2 inhibe también alostéricamente a la FBPasa-1, lo que tiene dos consecuencias inmediatas: la ruta de la gluconeogénesis se ve inhibida y a su vez, la de la glucolisis se ve potenciada. Esta inhibición parece ser sinérgica con la producida por el AMP, otro inhibidor alostérico de la FBPasa-1. Cuando la concentración de AMP es muy baja, esta coordinación entre la Fru-2,6-P2 y el AMP permite obtener unos niveles de inhibición de la FBPasa-1 similares a los obtenidos con elevadas concentraciones de AMP. Sin embargo, la inhibición producida por Fru-2,6-P2 parece verse reducida en condiciones tanto de elevados niveles de pH como de altas temperaturas.[5]
Regulación de la síntesis
La concentración de Fru-2,6-P2 en las células es controlada por medio de la regulación de la síntesis y degradación de la enzima bifuncional PFK-2/FBPasa-2. Esta regulación es llevada a cabo principalmente por dos hormonas, la insulina y el glucagón, cuyas actividades pueden inducir en esta enzima reacciones de fosforilación/defosforilación. La liberación de glucagón induce la producción de AMPc, que a su vez activa una proteína quinasa dependiente de AMPc. Esta quinasa fosforila a la enzima PFK-2/FBPasa-2 en el grupo NH2 de un residuo de serina, transfiriendo el fosfato desde una molécula de ATP, lo que provoca la activación de la FBPasa-2 a la vez que la inhibición de la PFK-2, y de esta forma, una reducción de los niveles de Fru-2,6-P2 en la célula. Con la disminución de los niveles de Fru-2,6-P2, la glucolisis se ve inhibida y la gluconeogénesis activada. Por el contrario, la liberación de insulina induce la respuesta opuesta, por medio de la activación de una fosfoproteína fosfatasa, que defosforila la enzima, con lo que se activa la PFK-2 y se inhibe la FBPasa-2, y por tanto, se induce la glucolisis y se reprime la gluconeogénesis.[6] [7]
Regulación de la síntesis de sacarosa
La Fru-2,6-P2 juega un importante papel en la regulación de las triosas fosfato, el producto final del ciclo de Calvin. En el ciclo de Calvin, casi todas las triosas fosfato (≈ 85%) son recicladas para sintetizar ribulosa 1,5-bisfosfato. El resto de las triosas fosfato (≈ 15%) pueden ser convertidas en sacarosa o almacenadas en forma de almidón. La Fru-2,6-P2 inhibe la producción de fructosa-6-fosfato, un monosacárido necesario para la síntesis de sacarosa. Cuando la tasa fotosintética en la fase luminosa es alta, las triosas fosfato son producidas de forma constante y la producción de Fru-2,6-P2 se ve inhibida, con lo que se sintetiza sacarosa. La producción de Fru-2,6-P2 es activada cuando las plantas se encuentran en ausencia de luz, con lo que la tasa fotosintética es baja y no tiene lugar la producción de triosas fosfato.[8]
Referencias
- ↑ a b Fructose 2,6-bisphosphate. <http://www.cbs.umn.edu/biochemistry/LangeLab/KB.html>
- ↑ Wu, C, Khan, S.A., Peng L.J., Lange A.J. 2006. Roles for fructose-2,6-bisphosphate in the control of fuel metabolism: beyond its allosteric effects on glycolytic and gluconeogenic enzymes. Adv. Enzyme Regul. 46: 72-88. <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?itool=abstractplus&db=pubmed&cmd=Retrieve&dopt=abstractplus&list_uids=16860376>
- ↑ Kurland IJ, Pilkis SJ (1995). «Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme». Protein Sci. 4 (6): pp. 1023–37. PMID 7549867. http://www.proteinscience.org/cgi/reprint/4/6/1023.
- ↑ KEGG REACTION: R02730
- ↑ Schaftingen, E.V., Hers, H.G. 1981. Inhibition of fructose-1,6-bisphosphatase by fructose 2,6-bisphosphate. Proc. Natl. Acad. Sci. USA. 78: 2861-2863. <http://www.pnas.org/cgi/content/abstract/78/5/2861>
- ↑ Kurland, I.J., Pilkis, S.J. 1995. Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: Insights into autoregulation of a bifunctional enzyme. Protein Sci. 4: 1023-1037. <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?itool=abstractplus&db=pubmed&cmd=Retrieve&dopt=abstractplus&list_uids=7549867>
- ↑ Smith, W.E., Langer, S., Wu, C., Baltrusch, S., Okar, D.A. 2007. Molecular Coordination of Hepatic Glucose Metabolism by the 6-Phosphofructo-2-kinase/Fructose-2,6-bisphosphatase:Glucokinase Complex. Mol. Endocrinol. <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Retrieve&dopt=AbstractPlus&list_uids=17374851&query_hl=1&itool=pubmed_docsum>
- ↑ Nielsen, T.H., Rung, J.H., Villadsen, D. 2004. Fructose-2,6-bisphosphate: a traffic signal in plant metabolism. Trends Plant Sci. 9: 556-63. <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Retrieve&dopt=AbstractPlus&list_uids=15501181&query_hl=1&itool=pubmed_docsum>
Véase también
- Fructosa 2,6-bifosfatasa
- Fructosa 1,6-bifosfato
- Fructosa-6-fosfato
- Fructosa-1-fosfato
- Fructosa
Categorías:- Monosacáridos
- Organofosforados
Wikimedia foundation. 2010.
