- GTP ciclohidrolasa
-
Las GTP ciclohidrolasas son unas enzimas que catalizan la reacción de hidrólisis del GTP. Se conocen hasta la fecha tres GTP ciclohidrolasas: I, II y IIa. Se diferencian entre ellas por los productos de la reacción de hidrólisis. Estas enzimas pertenecen a los números EC 3.5.4.- que corresponden a las enzimas hidrolasas que actúan sobre enlaces carbono-nitrógeno en amidinas cíclicas.
Contenido
GTP ciclohidrolasa I
GTP ciclohidrolasa I[1] 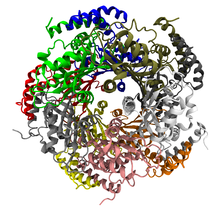
Decámero de la GTP ciclohidrolasa I.HUGO 4193 Símbolo GCH1 Datos genéticos Código de gen GCH1 Tipo de gen Gen Codificante Locus Cr. 14 q22.1-q22.2 Estructura/Función proteica Tamaño 250 (aminoácidos) Bases de datos Número EC 3.5.4.16 Entrez 2643 OMIM 600225 RefSeq NM_000161 UniProt P30793 La GTP ciclohidrolasa I (GCH1) (EC 3.5.4.16) cataliza la reacción de hidrólisis del GTP para obtener un compuesto derivado de la dihidropteridina y formato según la siguiente ecuación:[2]
- GTP + H2O
 formato + 2-amino-4-hidroxi-6-(eritro-1,2,3-trihidroxipropil)-dihidropteridina trifosfato
formato + 2-amino-4-hidroxi-6-(eritro-1,2,3-trihidroxipropil)-dihidropteridina trifosfato
La reacción consiste en la hidrólisis de dos enlaces carbono-nitrógeno y la isomerización de la unidad pentosa. La reciclización puede que no sea enzimática. La GCH1 participa en la síntesis de tetrahidrobiopterina (BH4) a partir de GTP conjuntamente con la sepiapterina reductasa (EC 1.1.1.153) y la 6-piruvoiltetrahidropterina sintasa (EC 4.2.3.12).[2]
La reacción catalizada por la GCH1 es la primera etapa de la biosíntesis del tetrahidrofolato en los procariotas, de la tetrahidrobiopterina en los vertebrados y de los pigmentos que contienen pteridina en los insectos.[3]
El pH óptimo de la enzima es 7,7 en un tampón fosfato. Es relativamente estable a altas temperatura. Retiene el 50% de su actividad después de incubarla a 70C durante 15 minutos.[4]
Funciones
La GCH1 regula positivamente la síntesis de óxido nítrico en las células endoteliales de la vena umbilical (células HUVEC). Puede que participe en la síntesis de dopamina. Puede modificar la sensibilidad al dolor y su persistencia. La isoforma GCH-1 es la enzima funcional, las funciones potenciales de las isoformas enzimáticamente inactivas (GCH-2, GCH-3 y GCH-4) son desconocidas.[4]
Regulación e inducción
El GTP muestra un efecto alostérico positivo sobre la GCH1. La tetrahidrobiopterina y el Mg2+ inhiben la actividad enzimática. Se requiere zinc para que enzima tenga actividad catalítica.[4]
El gen de la enzima es regulado positivamente por el interferón gamma, factor de necrosis tumoral, interleucina-1 beta, liposacáridos bacterianos y fenilalanina, y regulado negativamente por el dibutiril-cAMP, iloprost y 8-bromo-cGMP en las células HUVEC. La regulación positiva de la expresión de la GCH1, a su vez, estimula la producción de tetrahidrobiopterina con la subsecuente elevación de la actividad de la óxido nitrico sintasa endotelial. La regulación positiva inducida por citocinas de la GCH1 en las células HUVEC en respuesta al factor de necrosis tumoral y al interferón gamma supone la activación de las rutas NF-kappa-B y JAK2/STAT. El gen de la GCH1 también es regulado positivamente por el peróxido de hidrógeno en las células endoteliales de la aorta humana.[4]
Estructura
La GCH1 se presenta como un homodecámero de forma toroidal compuesto de un dímero de pentámeros. Las isoformas inactivas también forman decámeros y posibilemente estén presentes en los heterodecámeros de GCH1, teniendo por tanto una estabilidad y actividad menor.[4] La comparación de las secuencias de la enzima bacteriana y eucariota muestra que la estructura de esta enzima ha sido extremadamente bien conservada a través de la evolución.[3]
Localización celular y presencia en tejidos
La GCH1 tiene como localización celular el citoplasma. En la epidermis, se expresa predominantemente en los queratinocitos y en algunos melanocitos.[4]
Relevancia clínica
Los defectos en GCH1 son causa de la deficiencia en CTP ciclohidrolasa 1 (GCH1D), que es una de las causas de hiperfenilalaninemia maligna debida a deficiencia en tetrahidropbiopterina. Es también responsable de la neurotransmisión defectuosa debido a una disminución de los neurotransmisores dopamina y serotonina. Los principales síntomas incluyen: retardo psicomotor, desórdenes de tonicidad, convulsiones, somnolencia, irritabilidad, movimientos anormales, hipertermina, hipersalivación y dificultad para tragar. Algunos pacientes pueden presentar un fenotipo de hiperfenilalaninemia entre intermedia y severa, y distonía tipo 5 leve (distonia-parkinsonismo con fluctuación diurna). En este fenotipo intermedio, hay retraso motor marcado pero no hay retraso mental.[4]
Los defectos en GCH1 son causa de la distonía tipo 5 (DYT5), también conocida como distonía progresiva con fluctuación diurna, síndrome autosomal dominante de Segawa o distonía-parkinsonismo con fluctuación diurna. La distonía es definida por el transtorno con presencia de contracciones musculares involuntarias, que a menudo lleva a posturas anormales. La DYT5 se manifiesta típicamente en los niños con problemas para andar debido a la distonía de los miembros inferiores y un empeoramiento de la distonía hacia el anochecer. Está caracterizada por desordenes posturales y motores que muestran una marcada fluctuación diaria. La torsión del tronco no es usual. Los síntomas son aliviados después de dormir y agravados por la fatiga y el ejercicio. Hay una respuesta favorable a la L-3,4-dihidroxifenilalanina sin efectos secundarios.[4]
GTP ciclohidrolasa II
La GTP ciclohidrolasa II (EC 3.5.4.25) cataliza la reacción de hidrólisis del GTP para obtener un compuesto derivado de la pirimidina, formato y difosfato según la siguiente ecuación:[5]
- GTP + 3 H2O
 formato + 2,5-diamino-6-hidroxi-4-(5-fosfo-D-ribosilamino)pirimidina + difosfato
formato + 2,5-diamino-6-hidroxi-4-(5-fosfo-D-ribosilamino)pirimidina + difosfato
Durante la reacción se hidrolizan dos enlaces carbono-nitrógeno, liberando formato y eliminando simultáneamente el difosfato terminal.[5]
GTP ciclohidrolasa IIa
La GTP ciclohidrolasa IIa (EC 3.5.4.29) cataliza la reacción de hidrólisis del GTP para obtener un compuesto derivado de la pirimidinona y fosfato según la siguiente ecuación:[6]
- GTP + 3 H2O
 2-amino-5-formilamino-6-(5-fosfo-D-ribosilamino)pirimidin-4(3H)-one + 2 fosfato
2-amino-5-formilamino-6-(5-fosfo-D-ribosilamino)pirimidin-4(3H)-one + 2 fosfato
Esta enzima necesita como cofactor magnesio. También cataliza la hidrólisis del anillo imidazol de la guanosina 5'-trifosfato, N7-metilguanosina 5'-trifosfato e inosina 5'-trifosfato. Cataliza la hidrólisis del difosfato para obtener dos grupos fosfato. La xantosina 5'-trifosfato y el ATP no son sustratos.[6]
Referencias
- ↑ «GCH1». Consultado el 16 de octubre de 2011.
- ↑ a b «ENZYME entry: EC 3.5.4.16». Consultado el 16 de octubre de 2011.
- ↑ a b «GTP cyclohydrolase I signatures». Consultado el 16 de octubre de 2011.
- ↑ a b c d e f g h «GTP cyclohydrolase I». Consultado el 16 de octubre de 2011.
- ↑ a b «ENZYME entry: EC 3.5.4.25». Consultado el 16 de octubre de 2011.
- ↑ a b «ENZYME entry: EC 3.5.4.29». Consultado el 16 de octubre de 2011.
Categorías:- Genes del cromosoma 14
- Hidrolasas
- GTP + H2O
Wikimedia foundation. 2010.