- Gas de síntesis
-
El gas de síntesis o Sintegas (Syngas, en inglés) es un combustible gaseoso obtenido a partir de sustancias ricas en carbono (hulla, carbón, coque, nafta, biomasa) sometidas a un proceso químico a alta temperatura. Contiene cantidades variables de monóxido de carbono (CO) e hidrógeno (H2).
 Planta de gasificación de carbón en Tampa, para producir hidrógeno y electricidad.
Planta de gasificación de carbón en Tampa, para producir hidrógeno y electricidad.
Contenido
Métodos de producción
Según los diferentes métodos de producción[1] puede recibir diferentes nombres.
- Gas de alumbrado o gas de hulla: Se produce por pirólisis, destilación o pirogenación de la hulla[2] en ausencia de aire y a alta temperatura (1200-1300 °C), o bien, por pirólisis del lignito a baja temperatura. En estos casos se obtiene coque (hulla) o semicoque (lignito) como residuo, que se usa como combustible aunque no sirve para la industria del hierro. Este gas fue utilizado como combustible para el alumbrado público (luz de gas) a finales del siglo XIX y comienzos del siglo XX. Contiene un 45 % de hidrógeno, 35% de metano, 8 % de monóxido de carbono y otros gases en menor proporción.
- Gas de coque o gas de coquería: Se obtiene por calentamiento intenso y lento de la hulla (hulla grasa) con una combinación de aire y vapor, a alta temperatura, en las coquerías. Aparte del coque sólido fabricado, de gran interés para la industria siderúrgica y la síntesis de acetileno, se forma un gas que contiene hidrógeno, monóxido de carbono, nitrógeno y dióxido de carbono).[3]
- Gas de generador de gasógeno o gas de aire: Se obtiene haciendo pasar aire a través de una capa gruesa de gránulos de carbón o de coque incandescente. A mayor temperatura, mayor proporción de monóxido de carbono y menor proporción de dióxido de carbono.[4] Tiene escaso poder calorífico, mucho menor que el gas de agua, debido principalmente a la dilución con el nitrógeno atmosférico.
- Gas de agua: Se obtiene haciendo pasar vapor de agua sobre coque a alta temperatura. Su llama es de color azul por lo que también se llama gas azul. Este gas se puede transformar en metanol o alcanos, empleando catalizadores heterogéneos apropiados.[5] Esta reacción es fuertemente endotérmica por lo que requiere temperaturas muy altas.
- Gas pobre: Se obtiene haciendo pasar alternativamente vapor de agua y aire sobre carbón incandescente (alternancia de chorros de vapor y aire), y es una mezcla de los dos métodos anteriores.[6] Cuando el lecho de coque se ha enfriado a una temperatura a la que la reacción endotérmica ya no puede continuar, el vapor de agua es reemplazado por un chorro de aire. La formación inicial de dióxido de carbono (exotérmica) aumenta la temperatura del lecho de coque y va seguida por la reacción endotérmica en la que este (CO2) se convierte en monóxido de carbono (CO). La reacción global es exotérmica, originando "gas pobre". El oxígeno puro puede sustituir al aire para evitar el efecto de dilución, y en este caso el poder calorífico es más alto.
- Gas de agua carburado: Se obtiene mezclando gas de agua con petróleo gasificado en un carburador. Posee un poder calorífico más alto que los anteriores.[6]
- Gas ciudad: Se obtiene a partir de la oxidación de petróleo o algún derivado (fuel-oil, nafta) mediante vapor de agua y aire. Se debe eliminar el azufre para evitar la corrosión, y también el monóxido de carbono por su toxicidad. Ha sido reemplazado por el gas natural y los gases licuados del petróleo (GLP, como butano o propano) para todo tipo de fines, pues éste posee un poder calorífico doble. A veces se llama gas ciudad a cualquier gas de síntesis producido para abastecer el consumo doméstico y distribuido mediante redes de tuberías, ya sea obtenido a partir de carbón o de petróleo.[7]
- Gas natural sintético o gas de síntesis: Combustible que se fabrica a partir del carbón, del petróleo o de sus derivados, por métodos modernos, distintos de los procesos clásicos ya comentados:
- Reformado de gas natural con vapor de agua.
- Reformado de hidrocarburos líquidos para producir hidrógeno.
- Gasificación del carbón,[8] de la biomasa, y de algunos tipos de residuos en instalaciones de gasificación.
- Gasificación integral en ciclo combinado
Utilización del gas de síntesis
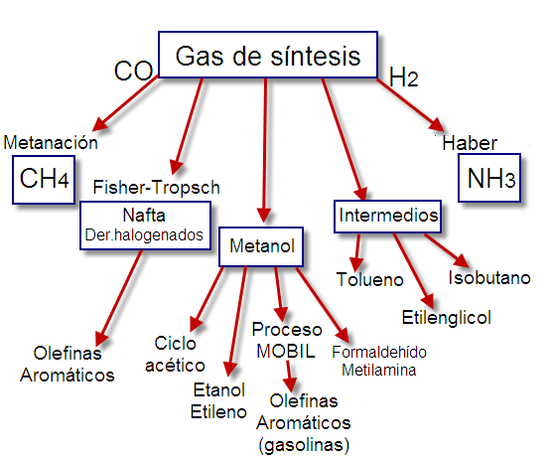
El nombre gas de síntesis proviene de su uso como intermediario en la creación de gas natural sintético (GNS)[9] y para la producción de amoníaco o metanol. El gas de síntesis también se utiliza como producto intermedio en la producción de petróleo sintético, para su uso como combustible o lubricante a través de la síntesis de Fischer-Tropsch, y previamente al proceso Mobil para convertir metanol en gasolina.
El gas de síntesis está compuesto principalmente de hidrógeno, monóxido de carbono, y muy a menudo, algo de dióxido de carbono. Posee menos de la mitad de densidad de energía que el gas natural. Se ha empleado y aún se usa como combustible o como producto intermedio para la producción de otros productos químicos.
Cuando este gas se utiliza como producto intermedio para la síntesis industrial de hidrógeno a gran escala (utilizado principalmente en la producción de amoniaco), también se produce a partir de gas natural (a través de la reacción de reformado con vapor de agua) como sigue:
Con el fin de producir más hidrógeno a partir de esta mezcla, se añade más vapor y así se produce el desplazamiento de la reacción del gas de agua:
El hidrógeno debe separarse del CO2 para poder usarlo. Esto se realiza principalmente por adsorción por oscilación de presión (PSA), limpieza de las aminas producidas y el empleo de reactores de membrana.
El gas de síntesis producido en las grandes instalaciones para la gasificación de residuos puede ser utilizado para generar electricidad.
Los procesos de gasificación de carbón se utilizaron durante muchos años para la fabricación de gas de alumbrado (gas de hulla) que alimentaba el alumbrado de gas de las ciudades y en cierta medida, la calefacción, antes de que la iluminación eléctrica y la infraestructura para el gas natural estuvieran disponibles.
Tratamiento posterior del gas de síntesis
El gas de síntesis puede ser utilizado en el proceso Fischer-Tropsch para producir diésel, o convertirse en metano y en dimetiléter en procesos catalíticos.
Si el gas de síntesis es tratado posteriormente mediante procesos criogénicos para su licuación, debe tenerse en cuenta que esta tecnología tiene grandes dificultades en la recuperación del monóxido de carbono puro si están presentes volúmenes relativamente grandes de nitrógeno, debido a que el monóxido de carbono y el nitrógeno poseen puntos de ebullición muy similares que son -191,5 ° C y -195,79 ° C, respectivamente. Algunas tecnologías de procesado eliminan selectivamente el monóxido de carbono por complejación / descomplejación del monóxido de carbono con cloruro de aluminio cuproso (CuAlCl4), disuelto en un líquido orgánico como el tolueno. El monóxido de carbono purificado puede tener una pureza superior al 99%, lo que lo convierte en una buena materia prima para la industria química. El gas residual del sistema puede contener dióxido de carbono, nitrógeno, metano, etano e hidrógeno. Dicho gas residual puede ser procesado en un sistema de adsorción por oscilación de presión para eliminar el hidrógeno, y este hidrógeno puede ser recombinado en la proporción adecuada junto con monóxido de carbono para la producción catalítica de metanol, diésel por el proceso de Fischer-Tropsch, etc. La purificación criogénica (condensación fraccionada), que requiere mucha energía, no es muy adecuada para la fabricación de combustible, simplemente porque la ganancia de energía neta es muy reducida.
Véase también
- Reacción de Boudouard
- Gasificación integrada en ciclo combinado
- Gasificación
- Oxidación parcial
- Gas de gasógeno
- Gas ciudad
- Gasificación subterránea del carbón
- Gas de agua
- Gas de madera
Enlaces externos
Referencias
- ↑ Termodinámica y Termotecnia. Tema 3: Combustibles y energías renovables.
- ↑ http://books.google.es/books?id=gXy0D6vWx7EC&pg=PA106 Fabricación del gas de alumbrado. En: Métodos de la industria química en esquemas de flujo en colores: una visión panorámica de los métodos de la industria química. Fritz Tegeder, Ludwig Mayer. Editorial Reverté, 1987. ISBN: 8429179623. Pág. 106
- ↑ http://energia3.mecon.gov.ar/contenidos/verpagina.php?idpagina=323 Glosario del balance energético. Secretaría de Energía. Ministerio de planificación federal, inversión pública y servicios. República Argentina. Último acceso:6 de febrero de 2010.
- ↑ Introducción a la química industrial. Angel Vian Ortuño. Editorial Reverté, 1999. ISBN: 842917933X. Pág. 405
- ↑ Química organometálica de los metales de transición. Robert H. Crabtree. Editorial de la Universitat Jaume I, 1997. ISBN: 8480211342. Pág. 400
- ↑ a b Historia de la tecnología. Volumen 4. T. K. Derry, Trevor I. Williams. Siglo XXI de España Editores, 1989. ISBN: 8432306134. Pág. 50
- ↑ Contaminación del aire por la industria. Albert Parker. Editorial Reverté, 1983. ISBN: 8429174648. Pág. 384
- ↑ Beychok, M.R., Coal gasification and the Phenosolvan process, American Chemical Society 168th National Meeting, Atlantic City, September 1974
- ↑ Beychok, M.R., Process and environmental technology for producing SNG and liquid fuels, U.S. EPA report EPA-660/2-75-011, May 1975
Categorías:- Carbón
- Combustibles
- Ingeniería química
- Petróleo
Wikimedia foundation. 2010.