- Miastenia gravis
-
Miastenia gravis 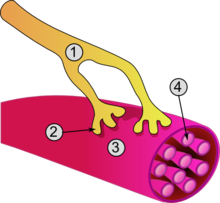
Vista de una unión neuromuscular:
1. axón
2. Motor end-plate
3. fibra muscular
4. miofibrillaClasificación y recursos externos CIE-10 G70 CIE-9 358.0 OMIM 254200 DiseasesDB 8460 Medline Buscar en Medline mediante PubMed (en inglés) MedlinePlus 000712 eMedicine neuro/{{{eMedicineTopic}}} emerg 325, med 3260, embarazo oph 263 MeSH D009157  Aviso médico
Aviso médico Reconstrucción informática de la estructura de la acetilcolinesterasa.
Reconstrucción informática de la estructura de la acetilcolinesterasa.
La miastenia gravis (MG) es una enfermedad neuromuscular autoinmune y crónica caracterizada por grados variables de debilidad de los músculos esqueléticos (los voluntarios) del cuerpo. La denominación proviene del latín y el griego, y significa literalmente «debilidad muscular grave».
Debuta con un cuadro insidioso de pérdida de fuerzas, que rápidamente se recuperan con el descanso pero que reaparece al reiniciar el ejercicio. Suele iniciarse en los músculos perioculares. En pocas ocasiones el inicio es agudo.
El nombre es ya inadecuado, de cuando no existía tratamiento pues con las terapias actuales la mayoría de los casos de miastenia gravis no son, para nada, graves como su nombre indica. De hecho, para la mayoría de pacientes con miastenia gravis, la esperanza de vida no disminuye a causa de su trastorno.
La característica principal de la miastenia gravis es una debilidad muscular que aumenta durante los períodos de actividad y disminuye después de períodos de descanso. Ciertos músculos, tales como los que controlan el movimiento de los ojos y los párpados, la expresión facial, la masticación, el habla y la deglución (tragar) a menudo se ven afectados por este trastorno. Los músculos que controlan la respiración y los movimientos del cuello y de las extremidades también pueden verse afectados, pero, afortunadamente, más tardíamente.
Etiología y fisiopatología
La miastenia gravis es causada por un defecto en la transmisión de los impulsos nerviosos a los músculos. Ocurre cuando la comunicación normal entre el nervio y el músculo se interrumpe en la unión neuromuscular, el lugar en donde las células nerviosas se conectan con los músculos que controlan.
Normalmente, cuando los impulsos recorren el nervio, las terminaciones nerviosas secretan una sustancia neurotransmisora llamada acetilcolina. La acetilcolina se desplaza a través de la sinapsis neuromuscular, y se adhiere a los receptores de acetilcolina, en la membrana post-sináptica. Los receptores se activan y generan una contracción del músculo.
En la miastenia gravis, los anticuerpos bloquean, alteran, o destruyen los receptores de acetilcolina en la unión neuromuscular, lo cual evita que ocurra la contracción muscular. Estos anticuerpos son producidos por el propio sistema inmunitario del cuerpo. Por ende, la miastenia gravis es una enfermedad autoinmune, porque el sistema inmunitario, que normalmente protege al cuerpo de organismos externos, se ataca a sí mismo por error. Además, se ha demostrado que los pliegues post-sinápticos están aplanados o "simplificados", disminuyendo la eficacia de la transmisión. La acetilcolina es liberada normalmente, pero los potenciales generados son de intensidad inferior a la necesaria.
Los mecanismos por los cuales los anticuerpos disminuyen el número de receptores son tres:
- Degradación acelerada por enlaces cruzados y endocitosis precoz de los receptores.
- Bloqueo del sitio activo del receptor.
- Lesión de la membrana muscular post-sináptica por los anticuerpos en colaboración con el sistema del complemento.
Los anticuerpos son del tipo IgG dependientes de linfocitos T, por lo que el tratamiento inmunosupresor constituye una diana terapéutica.
Por otro lado, la actividad repetida acaba disminuyendo la cantidad de acetilcolina liberada (lo que se conoce como agotamiento presináptico). También conlleva una activación cada vez menor de fibras musculares por impulso sucesivo (fatiga miasténica). Estos mecanismos explican el aumento de la fatiga tras el ejercicio, y la estimulación decreciente en el electromiograma.
El timo, es un órgano situado en el área superior del pecho debajo del esternón (hueso en el centro del pecho)exactamente en el mediastino anterior, desempeña un papel importante en el desarrollo del sistema inmunitario durante la etapa fetal. Sus células forman una parte del sistema inmunitario normal del cuerpo. La glándula es bastante grande en los niños, crece gradualmente hasta la pubertad y luego se reduce en tamaño hasta ser reemplazada por tejido graso con la edad. En los adultos que padecen de miastenia gravis, la glándula del timo es anormal. Contiene ciertos racimos de células inmunológicas características de una hiperplasia linfoide, una condición que generalmente se presenta solamente en el bazo y los ganglios linfáticos durante una respuesta inmunológica activa. Un 10% de los pacientes que padecen de miastenia gravis desarrollan timomas. Los timomas generalmente son benignos, pero pueden llegar a ser malignos. Suelen ser por la aparición de células mioides (similares a miocitos), que también pueden actuar como productoras del autoantígeno, y generar una reacción autoinmune contra el timo.
No se ha entendido completamente la relación entre la glándula del timo y la miastenia gravis. Los científicos creen que es posible que la glándula del timo genere instrucciones incorrectas sobre la producción de anticuerpos receptores de acetilcolina, creando así el ambiente perfecto para un trastorno en la transmisión neuromuscular. Sin embargo, sí se ha demostrado que el 65% de los pacientes miasténicos tienen un timo anómalo, y el 65% lo tienen hiperplásico.
Diagnóstico
Clínica: con base a los Signos y Síntomas, y según la gravedad encontramos:
- Cansancio agudo, falta de fuerza muscular
- La caída de uno o ambos párpados (ptosis)
- Visión nublada o doble (diplopía) a consecuencia de la debilidad de los músculos que controlan los movimientos oculares
- Marcha inestable o irregular, debilidad en los brazos, las manos, los dedos, las piernas y el cuello
- Dificultad para subir escaleras
- Cambio en la expresión facial, dificultad para sonreír y gesticular
- Dificultad para deglutir alimentos (sólidos: ya sea por la falta de fuerza para masticar y líquidos, como el agua por ejemplo, en consecuencia a la falta de fuerza para tragar)
- Dificultad para respirar
- Trastornos en el habla (disartria). La voz sale como "gangosa" en consecuencia de la falta de fuerza en las cuerdas vocales, la lengua, etc.
Prueba farmacológica: Principalmente se utiliza la Prueba con cloruro de edrofonio (prueba de Tensilon) endovenoso la cual tiene una sensibilidad del 80 a 95% en pacientes con miastenia gravis presentando mejoría inmediata sobre todo ante su facies característica. La dosis inicial es de 1 mg, seguida de 2,3 y 5 mg, en intervalos de 3 a 5 minutos. Para poder controlar síntomas grastrointestinales (o en casos menos frecuentes bradicardia e hipotensión) es necesario tener a mano una jeringa con atropina. Un 20% de los pacientes con MGO tiene una prueba falsa negativa.
Pruebas electrofisiológicas: Se basa en la estimulación eléctrica repetitiva de distintos nervios para detectar una alteración de la transmisión neuromuscular. El estudio se realiza aplicando de cuatro a seis estímulos a una frecuencia de 2 Hz, antes y después de 30 segundos de ejercicio. Se repiten estos estímulos en intervalos de 1 minuto hasta 5 minutos después de finalizado el ejercicio. La prueba se considera positiva cuando existe una diferencia de amplitud de más del 10% entre el primer y quinto potencial evocado. Esta prueba no es especifica de la Miastenia ya que puede ser positiva en otras enfermedades neuromusculares. Otro metodo diagnostico es la electromiografia de fibra aislada.
Anticuerpos contra receptores de acetilcolina: Esta prueba es la más fidedigna donde se va a identificar la presencia de ACRA en pacientes compatibles con miastenia gravis. Existen tres tipos de anticuerpos: bloqueantes, moduladores y de ligadura. Los ACRA están presentes en un 75-85% de los pacientes con Miastenia gravis generalizada. En entre un 10 y 50% de estos enfermos se detectan otros anticuerpos frente a un enzima muscular (MuSK, siglas en inglés de "muscular specific kinase").Aunque los falsos positivos son raros, se han observado en pacientes con lupus eritematoso y con enfermedades hepáticas autoinmunes.
Estudios radiológicos: Un 10% de los pacientes de Miastenia gravis padecen timomas. La mayoría de estos tumores son benignos pero son localmente invasores. Por esta razón, se recomienda obtener una tomografía computarizada o una resonancia magnética de torax en todo paciente diagnosticado.
Tratamiento
Hoy día, casi todos los pacientes pueden reanudar una vida normal con un tratamiento adecuado.Los más importantes son los siguientes:
Fármacos anticolinesterásicos
Son aquellos que inhiben la colinesterasa, enzima que degrada la acetilcolina. La mayoría de los pacientes experimenta al menos una mejoría parcial, aunque muy pocos una mejoría completa. La eficacia de todos los fármacos del grupo es similar.
El más utilizado en España y EEUU es la piridostigmina vía oral, con efectos que aparecen al cabo de 15 a 30 minutos del inicio y una duración de 3 a 4 horas. La dosis inicial es de 60 miligramos entre tres y cinco veces diarias, para después ajustar la dosis a las necesidades individuales del paciente. Los pacientes con debilidad para la masticación y la deglución pueden tomar el medicamento antes de las comidas. Existen fórmulas de acción prolongada, especialmente útiles para la noche, pero no se recomiendan durante el día porque su absorción es variable.La dosis útil máxima suele ser de 120 mg cada 3 a 6 h. Los pacientes deben conocer que la dosis de este fármaco debe modificarse con particular precaución, siempre bajo supervisión médica debido a la posibilidad de agravamientos importantes de la enfermedad tanto por aumentos como por reducción de su dosis. Esta recomendación es aplicable al resto de fármacos utilizados en esta enfermedad.
La sobredosis de anticolinesterásicos puede producir un aumento de la debilidad y otros efectos secundarios muscarínicos, como diarrea, espasmos abdominales, sialorrea (hipersalivación) o náuseas. Para evitar estos síntomas digestivos son útiles la atropina-difenoxilato y la loperamida.
Timectomía
La timectomía o extirpación quirúrgica del timo está ganando aceptación en el tratamiento de la miastenia gravis, debido a los resultados, eficacia y consecuencias observados en su utilidad para el tratamiento de los timomas. Está indicada en todos los pacientes con miastenia generalizada entre la pubertad y los 55 años como mínimo, y aún no hay consenso en su uso para otros grupos de edad, o en pacientes con debilidad limitada a la musculatura ocular. Debe llevarse a cabo en un hospital con experiencia en esta técnica quirúrgica.
Fármacos inmunosupresores
El uso de fármacos inmunosupresores (sobre todo glucocorticoides y azatioprina) se ha demostrado eficaz en el tratamiento de la miastenia gravis. La elección del tipo de fármaco debe estar basada en el balance riesgo-beneficio, así como en la urgencia del tratamiento. Es útil establecer un planteamiento a corto, medio y largo plazo.
Para conseguir una mejoría inmediata, se puede realizar plasmaféresis o administrar inmunoglobulina intravenosa (IVIg). A medio plazo, resulta útil el uso de glucocorticoides y ciclosporina, útiles en un plazo de unos 3 meses. Para el efecto a largo plazo (en torno a un año), los fármacos de elección son la azatioprina y el micofelonato mofetil (MMF). Para el tratamiento de pacientes ocasionales refractarios al tratamiento, un ciclo de ciflofosfamida a altas dosis puede resultar útil, e incluso curativo, por reestimulación del sistema inmunitario.
Corticoterapia
El uso adecuado de glucocorticoides es eficaz en la mayoría de los enfermos. Para conseguir los mínimos efectos adversos, conviene administrar una sola dosis de prednisona al día, inicialmente baja (15 a 25 miligramos diarios), para evitar la debilidad precoz que se produce en un tercio de los pacientes. Según la tolerancia, se sube la dosis gradualmente a razón de 5 mg al día, hasta dosis estables de 50 a 60 mg al día o una mejoría clínica notable. Posteriormente, se procede a una reducción gradual, preferentemente hasta la retirada total del tratamiento. Por norma, la mejoría comienza a notarse a las semanas de alcanzar las dosis máximas, y dura meses o años. Pocos pacientes pueden permitirse la retirada total de la corticoterapia. El control minucioso de los pacientes con corticoterapia es esencial.
Otros fármacos inmunosupresores
El resto de inmunosupresores mencionados pueden utilizarse de forma aislada o en combinación con los glucocorticoides.
La azatioprina es el más frecuentemente usado, debido a sus pocos efectos adversos, generalmente en combinación con corticoterapia, para utilizar dosis más bajas de ambos. El 10% de los pacientes no toleran este fármaco, por cuadros pseudogripales con fiebre y malestar general, depresión de la médula ósea o alteración de la función hepática. La dosis inicial es de 50 mg diarios, y si se tolera, se incrementa gradualmente hasta una reducción del gradiente leucocítico de 3000 a 4000/μl, excepto en pacientes con corticoterapia. También puede utilizarse el aumento del volumen corpuscular medio de los hematíes como indicador de tolerancia. El intervalo de dosificación habitual es de 2 a 3 miligramos por kg de peso. El efecto de la azatioprina es visible entre 3 a 6 meses tras el inicio del tratamiento. Nunca se debe combinar con alopurinol (tratamiento de la hiperuricemia), por el riesgo de la depresión de la médula ósea o intensificación de los efectos de la azatioprina.
La ciclosporina tiene una eficacia similar, y una aceptación creciente en el tratamiento de la miastenia, pero sus efectos beneficiosos son más rápidos. Por lo general se combinan con corticoterapia. La dosis habitual es de 4 a 5 mg/kg/día, divididos en dos tomas. Los efectos secundarios más frecuentes son la hipertensión y la nefrotoxicidad. Los valores sanguíneos mínimos se miden 12 horas después de la toma nocturna, y el intervalo terapéutico, medido por radioinmunoanálisis es de 150 a 200 nanogramos por litro.
El micofelonato mofetil (MMF) es útil en dosis de 1000 a 1500 miligramos dos veces al día. Actúa inhibiendo la síntesis de purinas de novo (única vía en los linfocitos), por lo que inhibe exclusivamente la proliferación de estas células. Al no atacar a los linfocitos preexistentes, la mejoría clínica tarda varios meses (hasta 12) en notarse. Su ventaja consiste en la práctica ausencia de efectos adversos, salvo diarrea o leucopenia ocasionales. Una de sus mayores desventajas es su elevado coste económico.
La ciclofosfamida se reserva para enfermos ocasionales resistentes a los demás fármacos.
El tacrolimus (FK503), un fármaco emparentado con la ciclosporina, se esta comenzando a utilizar en pacientes graves, muy seleccionados, que responden mal a otros fármacos.
Plasmaféresis
Es una de las opciones terapéuticas, y consiste en separar mecánicamente los anticuerpos patógenos del plasma sanguíneo del paciente. Se realiza en un ciclo de 4 o 5 intercambios, con 3 a 4 litros por intercambio, en periodos de 2 semanas. Este tratamiento consigue disminuir por un corto plazo de tiempo la concentración de anticuerpos anticolinesterasa, con mejoría clínica en muchos pacientes. Por tanto, es útil como medida temporal en pacientes graves o con utilidad prequirúrgica (por ejemplo, para la timectomía). Sin embargo no se ha demostrado utilidad de su uso a largo plazo.
Inmunoglobulina intravenosa
Miastenia Gravis ( MG ) es el prototipo de una enfermedad autoinmune. El curso de la enfermedad es irregular. Puede limitarse a los músculos del ojo, pero en la gran mayoría de los pacientes se generaliza.
La aplicación de IvIg se ha demostrado que es efectiva. Reportes de casos y estudios pequeños con IvIg en un total de 132 pacientes arrojo que el 74% respondió bien con IvIg. Un estudio encontró que un ciclo de tratamiento con 0.4g de Inmunoglobulina ( SANDOGLOBULINA liofilizada CSL BEHRING ) por kg. de peso corporal durante 5 días, mejoró la fuerza muscular en 11 pacientes de 12. El efecto fue identificado cuatro días después de comenzar la terapia y alcanzó un máximo después de 9 días, durando una media de 52 días.
Hace algunos años, clínicos Franceses compararon la eficacia y seguridad del intercambio de plasma e IvIg en un estudio extenso y aleatorio, en 87 pacientes con Miastenia Gravis. 43 pacientes recibieron la plasmaferesis, y los otros .04 g de Sandoglobulina, por peso corporal durante 3-5- días. Después de una calificación clínica, fue la mejoría de la fuerza muscular.
La terapia con IvIg puede ser útil en pacientes con Miastenia Gravis crónica, en quienes han fallado otros tipos de tratamientos.
Las Inmunoglobulinas Intravenosas, proveen de anticuerpos protectores faltantes. Los tratamientos con Inmunoglobulinas están en la práctica clínica desde hace más de dos decádas. Existen más de 1300 publicaciones médicas y científicas que describen el uso de las IvIg. Incluyen estudios clínicos. Existen el soporte adecuado de literaturas que apoya el uso de estas para el tratamiento de numerosas enfermedades.
Ref. Waldmann TA, Strober W. Metabolismo de Inmunoglobulinas. Progr Allergy. 1969; 13:1-100 Centros para el control y prevención de Enfermedades. Pacientes con Deficiencia Inmune-EEUU, 1997-1998. MMWR Morb Mortal Wkly Rep. 1999; 48(08):159-162.
Tratamiento de la crisis miasténica
Se define como crisis miasténica a la exacerbación de la debilidad muscular capaz de poner en riesgo la vida del paciente. Generalmente ocurre por insuficiencia respiratoria causada por debilidad de la musculatura intercostal y el diafragma, y sólo suele ocurrir en pacientes mal controlados. El tratamiento debe ser en una Unidad de Cuidados Intensivos, por un equipo con experiencia en el tratamiento de este tipo de crisis, de la insuficiencia respiratoria y de las complicaciones infecciosas y la terapia hidroelectrolítica.
Se debe excluir la posibilidad de que la crisis sea causada por un tratamiento excesivo de la medicación anticolinérgica (crisis colinérgica), suprimiendo el tratamiento temporalmente. Sin embargo, la causa más frecuente de la crisis es la infección recurrente, que altera la inmunidad del paciente. El enfermo miasténico con fiebre e infección debe ser tratado como cualquier paciente inmunodeprimido. Las bases del tratamiento consisten en la antibioterapia rápida y eficaz, la ventilación asistida y la fisioterapia respiratoria. La plasmaféresis y la IVIg suelen ser útiles para acelerar la recuperación del paciente.
Aspectos importantes
Si bien es cierto la miastenia gravis es una enfermedad autoinmune que disminuye la fuerza física del paciente, es importante revisar la debilidad - fragilidad emocional provocada por esta enfermedad. Es muy importante que los familiares del paciente entiendan lo difícil que es vivir con una enfermedad que "lleva de la euforia a la ira en un instante", con una enfermedad que "no permite realizar las actividades diarias de manera común".
Además del tratamiento médico, es imprescindible brindar al paciente con miastenia gravis apoyo psicológico para que le oriente y ayude a entender estos cambios violentos en su conducta, entender los mecanismos de la enfermedad y la aceptación de la misma. Básicamente es poder disponer de un espacio de contención y de ayuda que aporten a la mejoría. (MBHP, paciente con Miastenia Gravis)
El aspecto emocional está íntimamente ligado a la enfermedad, tanto es así, que hay fuertes evidencias para presumir que el desencadenante de este síndrome es justamente un evento emocional y/o estresante que ha vivido la persona y que actúa como disparador de la enfermedad sobre la base de una predisposición genética.
El paciente miasténico no sólo debe realizar terapia psicológica sino que además debe evitar situaciones estresantes que puedan empeorar su miastenia. Por ejemplo: discusiones, peleas, disgustos, situaciones límites, etc
Es importante también, que la persona con Miastenia se mantenga lo más activa posible. Que ocupe su tiempo en actividades como por ejemplo el estudio y el trabajo siempre y cuando se encuentre anímicamente y físicamente estable o lo mejor posible. También es importante hacer notar que el rendimiento en el trabajo o en los estudios se puede ver disminuido considerablemente , y que laboralmente requiere apoyo y evitar cargas de trabajo y/o estrés, pues de lo contrario seria un motivo para crear crisis miastenicas en el enfermo. Es recomendable realizar ejercicio físico.Caminar de acuerdo a la capacidad del enfermo y evitar fatigar demasiado los musculos. Si la enfermedad es más avanzada y no pueda hacer ejercicios de la manera convencional puede recurrir a la asistencia de un profesional (Kinesioterapeuta o fisioterapeuta) quien lo ayudará a realizar ejercicios que estén a su alcance para no perder el tono muscular incluso visintandolo en su hogar o en una eventual hospitalización. Los médicos por lo regular NO recomiendan más de 30 minutos de ejercicio físico. La enfermedad genera debilidad y si a eso se le suma sedentarismo e inactividad el cuadro empeora notablemente, pero cabe mencionar que si se siente muy fatigado el paciente puede tener una recaída, por lo que los ejercicios hay que hacerlos de manera moderada. Por eso es importante incorporar todos los recursos mencionados en este apartado para lograr una mejoría constante y una mejor calidad de vida.
Miastenia Gravis, casos famosos
El magnate griego Aristoteles Onassis tenía Miastenia Gravis y llegó a aparecer en público con cintas adhesivas pegadas en los párpados con el fin de poder mantenerlos abiertos y no dormir mantenecer toda la noche con imsonio.
La pianista venezolana de fama mundial Teresa Carreño (1853/1917) muere en Nueva York luego de que le fuera diagnosticada una "miastenia grave" la cual "causó la pérdida del control de los nervios y músculos de la cabeza, cara y garganta, y progresivamente se propagó hacia abajo hasta que alcanzó los órganos respiratorios y finalmente el corazón, el tan funesto día 12 de Junio de 1917" (carta de su último esposo, Arturo Tagliapietra). Static Major entró al Baptist Hospital East en Louisville el 25 de febrero 2008, quejándose de una tos persistente, ronquera, dificultad para hablar, mareos, dolores musculares y dificultad para respirar. Se le diagnosticó con miastenia gravis
Bibliografía
- Harrison, T. R. et al (2006). «Trastornos neurológicos». Principios de Medicina Interna. Chile: McGraw-Hill Interamericana. ISBN 970-10-5166-1
estasdos unidos.
Referencias
- CADIMI : Centro de Asistencia, Docencia e Investigación en Miastenia Gravis. [1]
- National Institute of Neurological Disorders and Stroke. (publicado bajo dominio público).
Categorías:- Enfermedades inmunológicas
- Enfermedades neurológicas
Wikimedia foundation. 2010.
