- PDE3
-
Fosfodiesterasa 3A Otros nombres Fosfodiesterasa A inhibida por el cGMP HUGO 8778 Símbolo PDE3A Símbolos alt. CGI-PDE A Datos genéticos Código de gen PDE3A Tipo de gen Gen codificante Locus Cr. 12 p12.2 Estructura/Función proteica Tamaño 1141 (aminoácidos) Bases de datos Número EC 3.1.4.17 Entrez 5139 OMIM 123805 RefSeq NM_000921 UniProt Q14432 Fosfodiesterasa 3B 
Fosfodiesterasa 3B del ser humano.Otros nombres Fosfodiesterasa B inhibida por el cGMP HUGO 8779 Símbolo PDE3B Símbolos alt. CGI-PDE B, CGIP1 Datos genéticos Código de gen PDE3B Tipo de gen Gen codificante Locus Cr. 11 p15.2 Estructura/Función proteica Tamaño 1112 (aminoácidos) Bases de datos Número EC 3.1.4.17 Entrez 5140 OMIM 602047 RefSeq NM_000922 UniProt Q13370 La PDE3 es una fosfodiesterasa especializada en romper enlaces fosfatos cíclicos. A este grupo de proteínas pertenecen al menos once familias genéticas relaccionadas entre si que difieren en su estructura primaria, afinidad por el substrato, respuestas a su efector y mecanismos de regulación. La mayor parte de las familias de fosfodiesterasas están comprendidas por más de un gen. La PDE3 es clínicamente significativa por su papel en la regulación del músculo cardíaco, músculo liso vascular y agregación plaquetaria y se han desarrollado inhibidores de la PDE3 como fármacos, pero su uso está limitado porque provoca arritmias y puede aumentar la mortalidad en algunos usos terapéuticos.
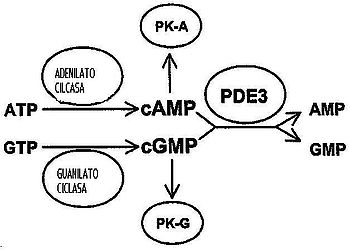
Cataliza la reacción de hidrólisis del fosfato cíclico del adenosín monofosfato cíclico (cAMP) y del guanosín monofosfato cíclico (cGMP), que son reguladores importantes de procesos fisiológicos.
- cAMP + H2O
 AMP
AMP
- cGMP + H2O
 GMP
GMP
Figura 1: Papel de PDE3 en la transducción de las señales mediadas por cAMP y cGMP. PKA: Proteina quinasa A (cAMP dependiente). PKG: Proteina quinasa G (cGMP dependiente).
Contenido
Estructura
Las PDEs de los mamíferos comparten una organización estructural común y contienen tres dominios funcionales: el núcleo catalítico, un extremo N-terminal regulador y el extremo C-terminal. El núcleo catalítico de las PDEs está bastante bien conservado, con un 80% de similitud entre las secuencia de aminoácidos de las diferentes PDEs. Se cree que el núcleo catalítico contiene elementos estructurales comunes que son importantes para la hidrólisis de los enlaces fosfodiéster del AMPc y GMPc. También se piensa que contienen regiones específicas que determinan las diferencias entre las diferentes PDEs por su afinidad por los substratos y por su sensibilidad a los inhibidores.[1] El dominio catalítico de la PDE3 se caracteriza por contener una secuencia de 44 aminoácidos que es única para la familia de la PDE3 y es un factor importante cuando se desea encontrar un inhibidor que sea potente y selectivo.[1]
Las estructuras por difracción de rayos X de los dominios catalíticos de varias PDE's incluida la PDE3B muestran que contienen tres subdominios en hélice:
- Zona N-terminal plegada similar a la de las ciclinas.
- Región o dominio conector.
- Dominio C-terminal en hélice.[2] [3]
En el interfaz de estos dominios se forma un profundo "bolsillo" o receptáculo hidrofóbico debido a residuos altamente conservados entre todas las PDE's. Este "bolsillo" es el sitio activo y está compuesto por cuatro subsitios:
- Zona de unión para metales (sitio M).
- Núcleo o core del pocket (Q pocket).
- Parte hidrofóbica del pocket(H pocket).
- Región periférica o Lid.(L region)[2] [3]
El sito M está en el fondo del receptáculo de unión o "binding pocket" y contiene dos sitios de unión para metales divalentes. Los iones metálicos que se pueden unir a ese sitio son el zinc o el magnesio. El sitio de unión del zinc tiene dos residuos de histidina y dos de aspartato que están conservados en todas las PDEs estudiadas hasta la fecha.[2] [3]
Las zonas N-terminal de las PDEs son ampliamente divergentes y contienen secuencias específicas que están asociadas con las propiedades reguladoras, diferentes entre las PDEs. Para la PDE3 estas secuencias específicas son los dominios hidrofóbicos asociados a la membrana y los sitios de fosforilación de la proteína quinasa A.[1]
Afinidad por el sustrato
Cuando se purificó la PDE3, ésta se describió como una enzima que hidrolizaba tanto GMPc como AMPc con valores de Km entre 0.1 – 0.8 µM. No obstante, la Vmax para la hidrólisis del AMPc es de 4 a 10 veces mayor que la Vmax para la hidrólisis de GMPc.[1]
Cuando se identificaron otras PDEs diferentes por primera vez, se aislaron dos tipos con gran afinidad para el AMPc, (PDE3 y PDE4). La PDE3 muestra gran afinidad por los dos substratos mencionados, mientras que PDE4 solo tiene alta afinidad para el AMPc. Por esa razón el PDE3 se llamó "PDE inhibida por GMPc" para distinguirla de la PDE4.[1]
El mecanismo molecular propuesto para la especificidad del nucleótido cíclico de la PDE es el interruptor de la glutamina. En las PDEs en las que se ha podido resolver su estructura parece que existe un residuo invariante de glutamina que establece la unión del anillo de purina al sitio activo (binding pocket). El grupo g-amino del residuo de glutamina puede adoptar alternativamente dos orientaciones diferentes:
- La red de enlaces de hidrógeno es responsable de la unión con la guanina - selectividad por GMPc.
- La red de enlaces de hidrógeno es responsable de la unión con la adenina - selectividad por AMPc.
En las PDE que pueden hidrolizar tanto GMPc como AMPc (PDE3s) las glutaminas pueden rotar libremente y por ello conmutan entre ambas orientaciones.[2] [3]
Isozimas de la PDE3
La familia de las PDE3 en los mamíferos consta de dos isozimas, PDE3A y PDE3B. Las isozimas de la PDE3 son estructuralmente similares, conteniendo un dominio N-terminal importante para la localización celular y un dominio final C-terminal.[4] El dominio catalítico difiere en las isozimas de la PDE3 y las regiones N-terminales de las isozimas son bastante divergentes. La PDE3A y la PDE3B tienen propiedades farmacológicas y cinéticas sorprendentemente similares pero se distinguen en sus perfiles de expresión así como en su afinidad por el GMPc.[2]
Localización de la PDE3
La PDE3A está implicada principalmente en la función cardiovascular y en la fertilidad, y la PDE3B esta implicada principalmente en la lipólisis.[2] La tabla 1 muestra la localización de las isozimas de la PDE3.
PDE3A PDE3B Localización en tejidos - Corazón *
- Músculo liso vascular*
- Plaquetas
- Oocito
- Riñón- Músculo liso vascular
- Adipocitos
- Hepatocitos
- Riñón
- células β
- espermatozoides en desarrollo
- linfocitos T
- Macrófagoslocalización intracelular - Asociada a la membrana plasmática o citosólica - Predominantemente asociada a Membrana Tabla 1: Vista general de la localización de las isoformas de la PDE3.
* Las variantes de la PDE3A tienen una expresión diferencial en los tejidos cardiovasculares.[3]En general, la PDE3 puede estar unida a membranas plasmáticas o citosólicas, retículo sarcoplasmático, aparato de golgi o envoltura nuclear.[4] La PDE3B está predominantemente asociada a membrana y se localiza en el retículo endoplasmático y las fracciones microsomales.[3] La PDE3A puede estar tanto asociado a membrana como en forma citosólica dependiendo de la variante como del tipo de célula en el que se expresa.[3]
Perfil genético
La familia de las PDE3 está compuesta por dos genes, PDE3A y PDE3B. En las células en las que se exprean ambos genes, el PDE3A es el habitualmente dominante. Las tres isoformas diferentes de la PDE3A (PDE3A1-3) son productos de una transcripción alternativa del mismo gen. El gen PDE3B codifica una única isoforma.[3] [5]
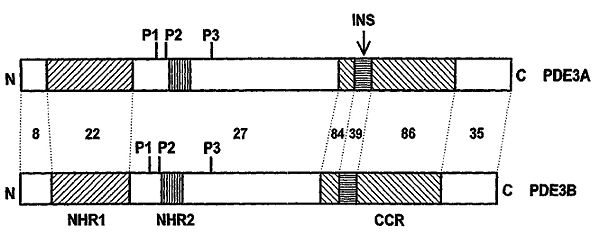
En la forma completa, tanto la PDE3A como la PDE3B contienen dos regiones hidrofóbicas N-terminales que se asocian a la membrana, NHR1 y NHR2 (figura 2). La diferencia de las variantes PDE3A1-3 radica en si estas incluyen:
- Tanto NHR1 como NHR2.
- Sólo NHR2.
- Ni NHR1 ni el NHR2.
Se cree que la última es exclusiva de la forma soluble/citosólica.[5] [6]
Figura 2: Ilustración esquemática de los marcos abiertos de lectura (ORF's) de los genes PDE3A y PDE3B mostrando las regiones hidrofóbicas N-terminales NHR1 y NHR2. Lectura: CCR región catalítica conservada, INS inserto de 44 aminoácidos en CCR, P1-3 lugares de fosforilación en PDE3. Las cifras entre las lineas de puntos implican el % en la identidad de la secuencia de aminoácidos de las regiones homólogas.
Regulación
Las actividades de la PDE3A y PDE3B están reguladas por varias vías de fosforilación. La proteína qinasa A y la proteína quinasa B activan la PDE3A y la PDE3B vía fosforilación en dos sitios diferentes (P1 y P2) situadas entre las zonas NHR1 y NHR2 (figura 2). La hidrólisis del AMPc por la PDE3 también está directamente inhibida por GMPc aunque la PDE3B es ≈10% menos sensible a la inhibición por cGMP que el PDE3A.[5]
La PDE3B ha sido extensamente estudiada por su importancia en la mediación de los efectos antilipolíticos y antiglucogénicos de la insulina en los tejidos adiposos y hepáticos. La activación de la PDE3B en los adipocitos está asociado con la fosforilación de un residuo de serina por una proteína serina-quinasa estimulada por insulina (PDE3IK).
Bloqueando la activación por parte de la insulina de la PDE3IK y a su vez la fosforilación/activación de la PDE3B se puede antagonizar el efecto antilipolítico de la insulina. La activación de la PDE3B baja las concentraciones de AMPc que a su vez reduce la actividad de la proteína quinasa A. La proteín quinasa A es responsable de la activación de la lipasa que induce la lipolisis así como otras vías fisiológicas.[1] [5]
Función de la PDE3
Las enzimas PDE3 están implicadas en la regulación de la contracción del músculo cardiaco y el músculo liso vascular. Originalmente se investigó las moléculas que inhibían la PDE3 para el tratamiento de la insuficiencia cardíaca pero debido a los efectos secundarios, en especial la arritmia ya no se han vuelto a estudiar con estos fines. No obstante, el inhibidor de la PDE3 llamado milrinona está aprobado para uso en la insuficiencia cardiaca administrado por vía intravenosa.[3]
Tanto la PDE3A como la PDE3B se expresan en las células del músculo liso vascular y probablemente modulan su contracción. Su expresión en el músculo vascular liso se puede alterar bajo condiciones específicas como niveles elevados de AMPc e hipoxia.[3]
Los inhibidores de las PDEs:
- Antagonizan la agregación plaquetaria.
- Bloquean la maduración de los oocitos.
- Incrementan la contractibilidad del corazón.
- Promueven la relajación del músculo liso vascular.
- Promueven la relajación del músculo liso en las vías aéreas.
Se ha demostrado que la inhibición de la PDE3A impide la maduración de los oocitos in vitro e in vivo.[3] Por ejemplo, cuando se obtienen ratones completamente deficientes en PDE3A, resultan infértiles.[4]
La agregación plaquetaria está altamente regulada por nucleótidos cíclicos. El PDE3A es un regulador de este proceso y los inhibidores de las fosfodiesterasas (PDEs) impiden eficazmente la agregación. El cilastazol es un tratamiento aprobado y se piensa que actúa inhibiendo la agregación plaquetaria y también la inhibición de la proliferación del músculo liso y la vasodilatación.
Las funciones más estudiadas de la PDE3B han sido en el área de la señalización de la insulina, el IGF-1 y la leptina.[3] Cuando se sobreexpresa la PDE3B en las células β de ratones, se provoca una secreción de insulina alterada e intolerancia a la glucosa.[4]
La implicación de la PDE3B en la regulación de esas rutas importantes ha animado a los investigadores a comenzar investigaciones sobre los posibles roles de esta enzima en afecciones como la obesidad, diabetes y celulitis.[7]
REF (relacciones estructura-función)
Desde los primeros estudios se derivó un modelo inicial de la topografía del sitio activo de la PDE. Este modelo se puede resumir en los siguientes pasos que tienen que ver con la topografía del sitio activo para el AMPc:
- El sustrato AMPc se sitúa con sus porciones adenina y ribosa en "antirelación".
- El átomo de fósforo del AMPc se une al sitio activo de la PDE utilizando un residuo de arginina y una molécula de agua, que inicialmente se asocia con Mg2+. Un segundo residuo de arginina y el Mg2+ pueden también desempeñar funciones durante la unión o en el siguiente paso.
- El ataque SN2 del fósforo por H2O con la formación de una pirámide trigonal (estado de transición).
- El 5´-AMP se forma como un producto "invertido". Las cargas electrónicas conservan la carga neta global y a través del estado de transición.[8]
Referencias
- ↑ a b c d e f Degerman E., Belfrage P., Manganiello V.C. (1997). Structure, localization, and regulation of cGMP-inhibited phosphodiesterase (PDE3). Journal of Biological Chemistry, 272(11): 6823-6826.
- ↑ a b c d e f Jeon Y.H., Heo Y.-S., Kim C.M., Hyun Y.-L., Lee T.G., Ro S., Cho J.M. (2005). Phosphodiesterase: overview of protein structures, potential therapeutic applications and recent progress in drug development. Cell. Mol. Life Sci., 62: 1198-1220.
- ↑ a b c d e f g h i j k l Bender A.T., Beavo J.A. (2006). Cyclic nucleotide phosphodiesterases: Molecular regulation to clinical use. Pharmacological Reviews, 58(3): 488-520.
- ↑ a b c d Lugnier C. (2006). Cyclic nucleotide phosphodiesterase (PDE) superfamily: A new target for the development of specific therapeutic agents. Pharmacology & Therapeutics, 109: 366-398.
- ↑ a b c d Maurice D.H., Palmer D., Tilley D.G., Dunkerley H.A., Netherton S.J., Raymond D.R., Elbatarny H.S., Jimmo S.L. (2003). Cyclic Nucleotide Phosphodiesterase Activity, Expression, and Targeting in Cells of the Cardiovascular System. Mol Pharmacol, 64: 533-546.
- ↑ Matthew M. (2003). Isoform-Selective Inhibitors and Activators of PDE3 Cyclic Nucleotide Phosphodiesterases. WO 2003/012030: International patent application (PCT), World Intellectual Property Organization.
- ↑ Massimiliana L., Sandro G., Alessandro G. (2006). Pharmaceutical Compositions for the Treatment of Cellulite. WO 2006/063714: International patent application (PCT), World Intellectual Property Organization.
- ↑ Erhardt P.W., Chou Y. (1991). A topographical model for the c-AMP phosphodiesterase III active site. Life Sciences, 49(8): 553-568.
- cAMP + H2O
Wikimedia foundation. 2010.