- Mifepristona
-
Mifepristona 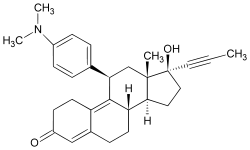

Nombre (IUPAC) sistemático 11β-[p-(Dimethylamino)phenyl]-<BR>17β-hydroxy-17-(1-propynyl)estra-<BR>4,9-dien-3-one Identificadores Número CAS 84371-65-3 Código ATC G03XB01 PubChem 55245 DrugBank DB00834 ChemSpider 49889 UNII 320T6RNW1F KEGG D00585 ChEBI 50692 Datos químicos Fórmula C29H35NO2 Peso mol. 429,60 g/mol SMILESO=C5\C=C4/C(=C3/[C@@H](c1ccc(N(C)C)cc1)C[C@]2([C@@H](CC[C@]2(C#CC)O)[C@@H]3CC4)C)CC5InChI=1S/C29H35NO2/c1-5-15-29(32)16-14-26-24-12-8-20-17-22(31)11-13-23(20)27(24)25(18-28(26,29)2)19-6-9-21(10-7-19)30(3)4/h6-7,9-10,17,24-26,32H,8,11-14,16,18H2,1-4H3/t24-,25+,26-,28-,29-/m0/s1
Key:VKHAHZOOUSRJNA-GCNJZUOMSA-NDatos físicos Densidad 1,189 g/cm³ P. fusión 194 °C (381 °F) Punto de ebullición 629 °C (1164 °F) Farmacocinética Biodisponibilidad 69% Unión proteica 98% Metabolismo Hepático Vida media 18 horas Excreción Fecal: 83%; Renal: 9% Datos clínicos Nombre comercial Mifeprex, Mifegyne Cat. embarazo X (USA) Usada para la terminación del embarazo Estado legal ℞-only (USA) Vías de adm. Oral La mifepristona es un compuesto sintético esteroideo usado como farmacéutico. Es un antagonista del receptor de progesterona usado como abortifaciente en los primeros meses de embarazo, y a dosis menores como un anticonceptivo de emergencia en los días posteriores al coito.[1] [2] Durante los primeros ensayos, se conocía como RU-38486 o simplemente RU-486, su designación en la compañía Roussel-Uclaf, quien diseñó el farmacéutico. La mifepristona es el anticonceptivo de emergencia de referencia en China y Rusia.[3] [4]
La mifepristona se utiliza como medicamento abortivo en la interrupción voluntaria del embarazo junto con un análogo de prostaglandina (usualmente el misoprostol), entre las primeras 7 a 9 semanas de embarazo (49 a 63 días).[5] [6] La mifepristona también es utilizada para tratar tumores cerebrales, endometriosis, fibroides y para inducir el parto en mujeres embarazadas.[7] El fármaco fue inicialmente disponible en Francia, y posteriormente otros países le siguieron—a menudo en medio de controversia. Se comercializa bajo los nombres comerciales Mifeprex y Mifegyne.
Contenido
Farmacología
En la presencia de progesterona, la mifepristona actúa como un antagonista del receptor de progesterona competitivo (en la ausencia de progesterona, la mifepristona actúa como un antagonista parcial). La mifepristona es un esteroide 10-nor con un sustituyente p-(dimetilamino)fenilo voluminoso arriba del plano de la molécula en la posición 11β responsable de inducir o estabilizar una conformación de receptor inactiva, y un sustituyente propinil hidrofóbico debajo del plano de la molécula en la posición 17α que incrementa su affinidad con el receptor de progesterona.[8] [9] [10]
Además de ser un antiprogestágeno, la mifepristona también es un antiglucocorticoide y un antiandrógeno débil. La afinidad relativa de la mifepristona en el receptor de progesterona es más del doble que el de la progesterona, su afinidad relativa de la mifepristona en el receptor de glucocorticoides es más de tres veces que el de la dexametasona y más de diez veces que el del cortisol; su afinidad relativa en el receptor androgénico es menos de un tercio que el de la testosterona. No se une con el receptor de estrógeno ni con el receptor de mineralcorticoides.[11]
La mifepristona como un anticonceptivo regular a 2 mg al día previene la ovulación (1 mg al día no lo hace). Una única dosis de 10 mg preovulatoria de mifepristona retarda la ovulación por 3 a 4 días y es tan efectiva como un anticonceptivo de emergencia como una unica dosis de 1,5 mg del progestágeno levonorgestrel[12]
En mujeres, la mifepristona a dosis mayores o iguales a 1 mg/kg antagoniza los efectos endometriales y miometriales de la progesterona. En humanos, un efecto antiglucocorticoide se manifiesta a dosis mayores o iguales a 4,5 mg/kg por un aumento compensatorio en ACTH y cortisol. En animales, un efecto antiandrogénico débil es visto con una administración prolongada de dosis muy altas de 10 a 100 mg/kg.[13] [14]
En regímenes abortivos, el bloqueo de mifepristona de los receptores de progesterona causa directamente una degeneración en el decidual, un ablandamiento y dilatación cervical, liberación de prostaglandinas endógenas y un incremento en la sensibilidad del miometrio a los efectos contráctiles de las prostaglandinas. La descomposición decidual inducida por la mifepristona conduce indirectamente a un desprendimiento del trofoblasto, resultando en una producción reducida de hCG por el sincitiotrofoblasto, que a su vez causa una disminución en la producción de progesterona por el cuerpo lúteo (el embarazo es dependiente de la producción de progesterona por el cuerpo lúteo durante las primeras 9 semanas de gestación -- hasta que la producción placental haya incrementado lo suficiente para ocupar el lugar de la producción de progesterona del cuerpo lúteo). Cuando la mifepristona es seguida secuencialmente por una prostaglandina, 200 mg de mifepristona es (100 mg podría ser, pero 50 mg no lo es) tan efectivo como 600 mg en la producción de un aborto médico.[8] [10]
Historia
En abril de 1980, como parte de un proyecto formal de investigación en Roussel-Uclaf para el desarrollo de un antagonista del receptor de glucocorticoides, el químico Georges Teutsch sintetizó la mifepristona (RU-38486, el compuesto número 38.486 por Roussel-Uclaf desde 1949 a 1980; acortado a RU-486); que también fue descubierto de ser un antagonista del receptor de progesterona.[15] [16] En octubre de 1981, el endocrinólogo Étienne-Émile Baulieu, un consultor para Roussel-Uclaf, organizó pruebas para su uso en abortos médicos en once mujeres en Suiza por el ginecólogo Walter Herrmann en el Hospital Cantonal de la Universidad de Ginebra, con exitosos resultados anunciados el 19 de abril de 1982.[15] [17] El 9 de octubre de 1987, siguiendo un ensayo clínico mundial de 20.000 mujeres usando la mifepristona con un análogo de prostaglandina (inicialmente sulprostona o gemeprost, posteriormente misoprostol) para el aborto médico, Roussel-Uclaf buscó la aprobación en Francia para su uso en abortos médicos, con la aprobación anunciada el 23 de septiembre de 1988.[15] [18]
El 21 de octubre de 1988, en respuesta a protestas antiabortistas y las preocupaciones del dueño mayoritario (54,5%) Hoechst AG de Alemania, los ejecutivos de Roussel-Uclaf y junta directiva votaron 16 a 4 para detener la distribución de mifepristona, que anunciaron el 26 de octubre de 1988.[15] [19] Dos días después, el gobierno francés ordenó a Roussel-Uclaf distribuir la mifepristona en interés de la salud pública.[15] [20] El ministro de Salud francés Claude Évin explicó que: "No podía permitir que el debate sobre el aborto privara a las mujeres de un producto que representa un avance médico. Desde el momento que el Gobierno aprobó el medicamento, el RU-486 se convirtió en la propiedad moral de las mujeres, no sólo la propiedad de una compañía farmacéutica."[15] Seguido por el uso de 34.000 mujeres en Francia desde abril de 1988 a febrero de 1990 de mifepristona distribuida de forma gratuita, Roussel-Uclaf comenzó a vender Mifegyne (mifepristona) a hospitales en Francia en febrero de 1990 a un precio (negociado con el gobierno de Francia) de $48 USD la dosis de 600 mg.[15]
El mifegyne fue posteriormente aprobado en Gran Bretaña el 1 de julio de 1991,[21] y en Suecia en septiembre de 1992,[22] pero hasta su retiro a fines de abril de 1994, el presidente de Hoechst AG, Wolfgang Hilger, un devoto católico, bloqueó toda nueva expansión en la disponibilidad de mifepristona.[15] [23]
El 16 de mayo de 1994, Roussel-Uclaf anunció que iba a donar sin remuneración todos los derechos para uso médico de la mifepristona en EE.UU. al Consejo de Población (Population Council),[24] que posteriormente licenció la mifepristona a Danco Laboratories, una nueva compañía de un solo producto inmune a boicoteos antiabortistas, quien ganó la aprobación de la FDA como Mifeprex el 28 de septiembre del 2000.[25]
El 8 de abril de 1997, después de comprar el 43,5% restante de las acciones de Roussel-Uclaf a principios de 1997,[26] Hoechst AG ($30 USD mil millones de ingresos anuales) anunció el final de su manufactura y venta de Mifegyne ($3,44 USD mil millones de ingresos anuales) y la transferencia de todos los derechos para el uso medico fuera de los Estados Unidos a Exelgyn S.A., una nueva compañía de un solo producto inmune a boicoteos antiabortistas, cuyo CEO era el ex CEO de Roussel-Uclaf, Édouard Sakiz.[27] En 1999, Exelgyn ganó la aprobación de Mifegyne en 11 países adicionales, y en 28 países más durante la siguiente década.[28]
Patente
La molécula fue protegida en la patente francesa 2,497,807 (9 de enero de 1981) y se obtuvo la patente europea 0057,115 B1 el 20 de marzo de 1985. En Estados Unidos se obtuvo la patente 4,386,085 el 31 de mayo de 1983.
Indicaciones
La mifepristona es vendida fuera de los Estados Unidos por Exelgyn Laboratories como Mifegyne, hecho en Francia, y está aprobada para:
- Terminación médica de embarazos intrauterinos de hasta 49 días de gestación (hasta 63 días de gestación en Gran Bretaña y Suecia)
- Ablandamiento y dilatación del cuello uterino antes de la dilatación cervical mecánica para la terminación del embarazo
- Usada en combinación con gemeprost para la terminación de embarazos de entre 13 a 24 semanas de gestación
- Inducción del parto en la muerte fetal en útero.[13]
La mifepristona es vendida dentro de los Estados Unidos por Danco Laboratories como Mifeprex, hecho en China,[29] y está aprobado por la FDA para la terminación de embarazos intrauterinos de hasta 49 días de gestación. Bajo el régimen aprobado por la FDA, una dosis de 600 mg es administrada por un médico seguido de una sesión de consejería. Dos días después, un médico administra 400 µg de otra medicina, misoprostol, para inducir contracciones. En estudios europeos, este método terminó el 96 a 99% de los embarazos de hasta 49 días de gestación, pero en un gran ensayo multicéntrico en los Estados Unidos llevado a cabo desde septiembre 1994 a septiembre 1995, la eficacia fue menor (92%), que los autores del estudio sugirieron que pudo haber sido debido a la falta de experiencia con este método en los Estado Unidos y/o el diseño del estudio.[30] En Europa y China, un periodo de observación de varias horas es requerida después de la administración de misoprostol. Si la expulsión del tejido fetal no ocurre durante el periodo de observación, se ofrece un aborto quirúrgico. El periodo de observación no es requerido en los Estados Unidos, pero es altamente recomendable.[31]
De acuerdo con la guía médica basado en evidencia actual del Colegio Real de Obstetras y Ginecólogos del Reino Unido:[32]
- Todos los métodos abortivos de primer trimestre conllevan un pequeño riesgo de fracaso en la terminación del embarazo, lo que exige un procedimiento adicional. El riesgo de un aborto quirúrgico es de alrededor de 0,23% y el de un aborto médico entre 0,1% y 1,4% (dependiendo del régimen usado y la experiencia del centro médico).
- El aborto médico usando mifepristona más prostaglandina es el método abortivo más efectivo en gestaciones menores a 7 semanas.
- La vacuoextracción convencional debería ser evitada en gestaciones menores a 7 semanas.
- La vacuoextracción temprana ocupando un protocolo riguroso (que incluye la magnificación del materia extraído e indicaciones para un seguimiento de βhCG) podría ser usada en gestaciones menores a 7 semanas, aunque los datos sugieren que la tasa de fracaso es más alta que el de un aborto médico.
- El aborto médico usando mifepristona más prostaglandina continúa siendo un método apropiado para las mujeres en el bando de 7-9 semanas de gestación.
Anticonceptivo de emergencia
La mifepristona también puede ser usada a menores dosis como un anticonceptivo de emergencia; si es que es tomada después del coito pero antes de la ovulación, la mifepristona puede prevenir la ovulación y por ende el embarazo. En este rol, una dosis de 10 mg no es tan efectiva como una de 600 mg, pero tiene menos efectos secundarios.[33] El uso de mifepristona en una dosis de 25 mg a 50 mg (considerada una dosis media) como anticonceptivo de emergencia viene avalado por estudios clínicos del año 2008[34] que consideran a la mifepristona junto con el levonorgestrel y el DIU, pero por delante de éstos, como métodos anticonceptivos de emergencia más efectivos que el método de Yuzpe, el danazol y anordrin, estando asociados a menos efectos secundarios.[35] [36] [37] [4] El Mifeprex y Mifegyne están disponibles sólo en tabletas de 200 mg[38]
El acetato de ulipristal y el levonorgestrel son los anticonceptivos hormonales postcoitales de referencia en América y Europa occidental. En China y Rusia el anticonceptivo de urgencia más utilizado es la mifepristona.[39] [4]
Una revisión de estudios en seres humanos encontró que los efectos anticonceptivos de una dosis de 10 mg eran probablemente debido principalmente a sus efectos en la ovulación, y no en la inhibición de la implantación, pero "el conocimiento del mecanismo de acción sigue siendo incompleto." Tratamientos con 200 mg de mifepristona cambia la expresión de receptores esteroideos en las trompas de Falopio, inhibiendo el desarrollo endometrial, y efectivamente previniendo la implantación.[40]
Otros usos
Otras aplicaciones médicas de la mifepristona que han sido estudiadas en la Fase II de ensayos clínicos incluye el uso regular y a largo plazo como un anticonceptivo oral, y el tratamiento de: miomas, endometriosis, depresión con rasgos psicóticos, glaucoma, meningiomas, cáncer de mama, cáncer de ovario, y cáncer de próstata. La mifepristona ha sido usada para tratar el síndrome de Cushing con tratamientos durando hasta 10 años sin efectos adversos notables.[41]
La mifepristona ha sido estudiada como un antirretroviral por su interferencia in vivo con la proteína reguladora vpr del VIH. No mostró actividad anti-VIH detectable en ensayos clínicos.[42] [9] [12] [43] Actualmente está siendo estudiada como un tratamiento para el síndrome del Golfo.[44] La mifepristona no ha sido aprobada por la FDA para ninguno de estos usos.
La mifepristona ha mostrado una eficacia significativa[45] en la depresión psicótica mayor, una forma de depresión resistente al tratamiento normal. El efecto fue rapido y el estudio fue doble ciego, pero era limitado por un pequeño grupo de estudio y de un tiempo de tratamiento limitado.
También se ha descrito como un agente de maduración cervical.[46]
Contraindicaciones
En ensayos clínicos, casi todas las mujeres que usando mifepristona experimentaron dolor abdominal, calambres uterinos, y sangrado o manchado vaginal por un promedio de 9-16 días. Hasta un 8% de las mujeres experimentaron algún tipo de sangrado por 30 días o más. Otros efectos secundarios menos comunes incluyeron nausea, vómito, diarrea, mareos, fatiga, y fiebre.[47] La enfermedad pélvica inflamatoria (EPI) es una rara pero seria complicación.[48] El sangrado excesivo y la terminación incompleta del embarazo requiere de una intervención adicional por un doctor (tal como una vacuoextracción). Entre 4,5 y 7,9% de las mujeres requirieron una intervención quirúrgica en los ensayos clínicos.[47] La mifepristona está contraindicada en la presencia de un dispositivo intrauterino (DIU), como tambien en embarazos ectópicos, falla suprarrenal, trastornos hemorrágicos, porfiria heredada, y terapias de anticoagulantes o de corticosteroides de largo plazo.[47]
La información prescrita por la FDA indica que no existen datos sobre la seguridad y eficacia de la mifepristona en mujeres con condiciones médicas crónicas, y que "las mujeres que tienen más de 35 años de edad y que también fumen más de 10 cigarrillos al día deberian tratarse con cuidado debido que dichos pacientes fueron generalmente excluidos de los ensayos clínicos de la mifepristona."[47]
Efectos adversos
No se han hecho estudios de largo plazo para evaluar el potencial carcinogénico de la mifepristona. Los resultados de estudios hechos in vitro y en animales revelaron ningún potencial genotóxico de la mifepristona.
La expuesta neonatal a una sola dosis alta de mifepristona en ratas no fue asociada con ningún problema reproducitvo, aunque la exposición crónica a bajas dosis de mifepristona en ratas recién nacidas fue asociada con anormalidades reproductivas estructurales y funcionales.[47]
Estudios teratológicos en ratones, ratas y conejos mostraron teratogenicidad para los conejos, pero no en ratas ni ratones.[47] La tasa de defectos de nacimiento en infantes humanos expuestos in utero a la mifepristona y misoprostol es muy baja,[49] y podría ser debido únicamente al misoprostol.[50]
Un sumario de postcomercialización encontró que, de los alrededor de 1,52 millones de mujeres que han recibido mifepristona hasta abril de 2011 en los Estados Unidos, catorce habrían fallecido después de la aplicación. Ocho de estos casos fueron asociados con sepsis; los otros seis tuvieron varios casos como abuso de drogas y sospecha de asesinato. Otros incidentes divulgados a la FDA incluyeron 612 hospitalizaciones no letales, 339 transfusiones de sangre, 48 infecciones graves, y en conjunto 2.207 (0,15%) eventos adversos.[51]
Véase también
- Métodos anticonceptivos
- Anticonceptivos de emergencia
-
- Dispositivo intrauterino - DIU
- Acetato de ulipristal - Píldora de los cinco días después
- Levonorgestrel - Píldora del día después
- Meloxicam
Referencias
- ↑ Mittal S. Intervenciones para la anticoncepción de emergencia: Comentario de la BSR (última revisión: 1 de noviembre de 2008). La Biblioteca de Salud Reproductiva de la OMS; Ginebra: Organización Mundial de la Salud.
- ↑ Prospecto de Misive 200 Microgramos -comprimidos vaginales de Misoprostol, sinaem, Ministerio de Sanidad, España
- ↑ El Dr. Horacio Croxatto confirma que el acetato de Ulipristal es el anticonceptivo de urgencia no hormonal más eficaz para la mujer, en Noticiasmedicas.es, 26/3/2010
- ↑ a b c Emergency Contraception: A Last Chance to Prevent Unintended Pregnancy, James Trussell, PhD1, Elizabeth G. Raymond, MD, MPH2, September 2010
- ↑ Ver aspectos generales de Esquema de Mifepristona/Misoprostol
- ↑ España, a la cola europea en aborto farmacológico, Solo un 4% de las interrupciones se realiza por este método, mientras en la UE se acercan a la mitad, 23/11/2010
- ↑ Mifepristona en MedlinePlus medicinas
- ↑ a b in Brunton, Laurence L.; Lazo, John S.; Parker, Keith L. (eds.), ed (2006). «Estrogens and Progestins». Goodman & Gilman's The Pharmacological Basis of Therapeutics (11th edición). New York: McGraw-Hill. pp. 1541–1571. ISBN 0-07-142280-3.
- ↑ a b in Brunton, Laurence L.; Lazo, John S.; Parker, Keith L. (eds.), ed (2006). «Adrenocorticotropic Hormone; Adrenocortical Steroids and Their Synthetic Analogs; Inhibitors of the Synthesis and Actions of Adrenocortical Hormones». Goodman & Gilman's The Pharmacological Basis of Therapeutics (11th edición). New York: McGraw-Hill. pp. 1587–1612. ISBN 0-07-142280-3.
- ↑ a b Fiala C, Gemzel-Danielsson K (2006). «Review of medical abortion using mifepristone in combination with a prostaglandin analogue». Contraception 74 (1): pp. 66–86. doi:. PMID 16781264.
- ↑ Heikinheimo O, Kekkonen R, Lahteenmaki P (2003). «The pharmacokinetics of mifepristone in humans reveal insights into differential mechanisms of antiprogestin action». Contraception 68 (6): pp. 421–6. doi:. PMID 14698071.
- ↑ a b Chabbert-Buffet N, Meduri G, Bouchard P, Spitz IM (2005). «Selective progesterone receptor modulators and progesterone antagonists: mechanisms of action and clinical applications». Hum Reprod Update 11 (3): pp. 293–307. doi:. PMID 15790602.
- ↑ a b Exelgyn Laboratories (February de 2006). «Mifegyne UK Summary of Product Characteristics (SPC)». Consultado el 09-03-2007.
- ↑ Danco Laboratories (July 19, de 2005). «Mifeprex US prescribing information» (PDF). Archivado desde el original, el 2007-01-07. Consultado el 09-03-2007.
- ↑ a b c d e f g h Baulieu, Étienne-Émile; Rosenblum, Mort (1991). The "abortion pill" : RU-486, a woman's choice. New York: Simon & Schuster. ISBN 067173816X.
Lader, Lawrence (1991). RU 486 : the pill that could end the abortion wars and why American women don't have it. Reading: Addison-Wesley. ISBN 0201570696.
Villaran, Gilda (1998). «RU 486». En Schlegelmilch, Bodo B. (ed.). Marketing ethics : an international perspective. London: Thomson Learing. pp. 155–190. ISBN 186152191X.
Ulmann, André (2000). «The development of mifepristone: a pharmaceutical drama in three acts». J Am Med Womens Assoc 55 (3 Suppl): pp. 117–20. PMID 10846319. - ↑ Teutsch, Georges (24 de noviembre de 1989). «RU 486 development». Science 246 (4933): p. 985. doi:. PMID 2587990.
«Dispute surfaces over paternity of RU 486». Science 246 (4933): p. 994. 24 de noviembre de 1989. doi:. PMID 2587988.
«RU 486 development». Science 246 (4943): p. 622. 9 de febrero de 1990. doi:. PMID 2300819.
«RU 486». Scientific American 262 (6): pp. 42–8. June 1990. doi:. PMID 2343294.
Teutsch, G.; Deraedt, R.; Philibert, D. (1993). «Mifepristone». En Lednicer, Daniel (ed.). Chronicles of drug discovery, Vol. 3. Washington, DC: American Chemical Society. pp. 1–43. ISBN 0841225230.
«History and perspectives of antiprogestins from the chemist's point of view». Human Reprod 9 (Suppl 1): pp. 12–31. June 1994. PMID 7962457.
Sittig, Marshall (ed.), ed (2007). «Mifepristone». Pharmaceutical manufacturing encyclopedia (3rd edición). Norwich, NY: William Andrew Publishing. pp. 2307–2310. ISBN 1601193394.
Plantilla:US patent reference assigned to Roussel Uclaf - ↑ Eder, Richard. «Birth control: 4-day pill is promising in early test», 20 de abril de 1982, p. C1.
Herrmann, Walter; Wyss, Rolf; Riondel, Anne; Philibert, Daniel; Teutsch, Georges; Sakiz, Edouard; Baulieu, Étienne-Émile (17 de mayo de 1982). «The effects of an antiprogesterone steroid in women: interruption of the menstrual cycle and of early pregnancy». C R Seances Acad Sci III 294 (18): pp. 933–8. PMID 6814714. - ↑ Kolata, Gina. «France and China allow sale of a drug for early abortion», 24 de septiembre de 1988, p. A1.
- ↑ Greenhouse, Steven. «Drug maker stops all distribution of abortion pill», 27 de octubre de 1988, p. A1.
- ↑ Greenhouse, Steven. «France ordering company to sell its abortion drug», 29 de octubre de 1988, p. A1.
- ↑ Smith, W. (September 1991). «Great Britain second country to allow use of RU-486». Plan Parent Eur 20 (2): p. 20. PMID 12284548.
- ↑ . (December 1992). «RU 486 licensed in Sweden». IPPF Med Bull 26 (6): p. 6. PMID 12346922.
- ↑ Newman, Barry. «Drug dilemma: among those wary of abortion pill is maker's parent firm; Germany's Hoechst is facing pressure from Clinton to sell RU-486 in U.S.», 22 de febrero de 1993, p. A1.
Associated Press. «F.D.A. says company delays abortion pill», 16 de abril de 1993, p. A14.
Jouzaitis, Carol. «Abortion pill battle surprises French firm», 17 de octubre de 1994, p. 1 (Business). - ↑ Seelye, Katharine Q.. «Accord opens way for abortion pill in U.S. in 2 years», 17 de mayo de 1994, p. A1.
- ↑ Kolata, Gina. «U.S. approves abortion pill; drug offers more privacy and could reshape debate», 29 de septiembre de 2000, p. A1.
- ↑ Moore, Stephen D.; Kamm, Thomas; Fleming, Charles. «Hoechst to seek rest of Roussel-Uclaf; expected $3.04 billion offer would add to the wave of drug-sector linkups», 11 de diciembre de 1996, p. A3.
Marshall, Matt. «Hoechst offers to pay $3.6 billion for rest of Roussel», 11 de diciembre de 1996, p. A8.
Bloomberg Business News. «Hoechst to buy rest of Roussel», 11 de diciembre de 1996, p. D4. - ↑ Bloomberg News. «Pill for abortion ends production», 9 de abril de 1997, p. D2.
Jouzaitis, Carol. «Abortion pill maker bows to boycott heat; German firm gives up RU-486 patent; little impact likely in U.S.», 9 de abril de 1997, p. 4.
Lavin, Douglas. «Hoechst will stop making abortion pill», 9 de abril de 1997, p. A3.
. (18 de abril de 1997). «Roussel-Uclaf to transfer RU 486 rights». Reprod Freedom News 6 (7): p. 8. PMID 12292550.
Dorozynski, Alexander (19 de abril de 1997). «Boycott threat forces French company to abandon RU486». BMJ 314 (7088): p. 1150. PMID 9146386. - ↑ . (4 de noviembre de 2009). «List of mifepristone approval». Gynuity Health Projects.
. (4 de noviembre de 2009). «Map of mifepristone approval». Gynuity Health Projects. Consultado el 11-06-2010. - ↑ Pan, Philip P.. «Chinese to Make RU-486 for U.S.», Washingtonpost.com, 12-10-2000. Consultado el 22-08-2006.
- ↑ Spitz IM, Bardin CW, Benton L, Robbins A (1998). «Early pregnancy termination with mifepristone and misoprostol in the United States». N Engl J Med 338 (18): pp. 1241–7. doi:. PMID 9562577.
- ↑ Suzanne Daley. «Europe Finds Abortion Pill is No Magic Cure-All», 'The New York Times', 5 de octubre de 2000. Consultado el 16-09-2006.
- ↑ RCOG (2004) (PDF). The Care of Women Requesting Induced Abortion : Evidence-based clinical guideline number 7. London: RCOG Press. ISBN 1-904752-06-3. http://www.rcog.org.uk/resources/Public/pdf/induced_abortionfull.pdf.
- ↑ Piaggio G et al. (2003). «Meta-analysis of randomized trials comparing different doses of mifepristone in emergency contraception». Contraception 68 (6): pp. 447–52. doi:. PMID 14698075.
- ↑ Biblioteca Virtual de la Salud - Cochrane BVS - OMS - Bireme - OPS-
- ↑ Intervenciones para la anticoncepción de emergencia. OMS
- ↑ Cheng L, Gülmezoglu AM, Piaggio G, Ezcurra E, Van Look PFA. Intervenciones para la anticoncepción de emergencia. Base de Datos de Revisiones Sistemáticas; 2008, Número 2. Art. n.º: CD001324. DOI: 10.1002/14651858.CD001324.pub3.
- ↑ Mittal S. Intervenciones para la anticoncepción de emergencia: Comentario de la BSR (última revisión: 1 de noviembre de 2008). La Biblioteca de Salud Reproductiva de la OMS; Ginebra: Organización Mundial de la Salud.
- ↑ Wertheimer, Randy E. (15-11-2000). «Emergency Postcoital Contraception». American Family Physician (American Academy of Family Physicians). http://www.aafp.org/afp/20001115/2287.html.
- ↑ El Dr. Horacio Croxatto confirma que el acetato de Ulipristal es el anticonceptivo de urgencia no hormonal más eficaz para la mujer, en Noticiasmedicas.es, 26/3/2010
- ↑ Gemzell-Danielsson, K.; Marions, L. (10-06-2004). «Mechanisms of action of mifepristone and levonorgestrel when used for emergency contraception». Human Reproduction Update (Oxford University Press) 10 (4): pp. 341–348. doi:. PMID 15192056.
- ↑ Healy, David (2009). "Mifepristone: an overview for Australian practice". Australian Prescriber, 32:152-154. Available at http://www.australianprescriber.com/magazine/32/6/152/4/
- ↑ Flexner, Charles. "HIV drug development: the next 25 years". Nat Rev Drug Discov. 2007 Dec;6(12):959-66.
- ↑ Tang OS, Ho PC (2006). Clinical applications of mifepristone. 22. pp. 655–9. doi:. PMID 17162706.
- ↑ «A Controlled Trial of Mifepristone in Gulf War Veterans With Chronic Multisymptom Illness». ClinicalTrials.gov. U.S. National Institutes of Health (June de 2008). Retrieved on November 7, 2008.
- ↑ Belanoff JK, Flores BH, Kalezhan M, Sund B, Schatzberg AF (October 2001). Rapid reversal of psychotic depression using mifepristone. 21. pp. 516–21. doi:. PMID 11593077. http://meta.wkhealth.com/pt/pt-core/template-journal/lwwgateway/media/landingpage.htm?issn=0271-0749&volumen=21&número=5&spage=516.
- ↑ Clark K, Ji H, Feltovich H, Janowski J, Carroll C, Chien EK (May 2006). Mifepristone-induced cervical ripening: structural, biomechanical, and molecular events. 194. pp. 1391–8. doi:. PMID 16647925.
- ↑ a b c d e f «Mifeprex label» (PDF). FDA (19-07-2005). Archivado desde el original, el 2006-06-28. Consultado el 22-08-2006.
- ↑ Lawton, BA et al. (2006). «Atypical presentation of serious pelvic inflammatory disease following mifepristone-induced abortion». Contraception 73 (4): pp. 431–2. doi:. PMID 16531180.
- ↑ Margaret M. Gary and Donna J. Harrison (December de 2005). «Analysis of Severe Adverse Events Related to the Use of Mifepristone as an Abortifacient». The Annals of Pharmacology. Consultado el 14-09-2006.
- ↑ Orioli, IM and Castilla, EE (2000). «Epidemiological assessment of misoprostol teratogenicity». BJOG 107 (4): pp. 519–23. doi:. PMID 10759272.
- ↑ Mifepristone U.S. Postmarketing Adverse Events Summary through 04/30/2011
Enlaces externos
- Mifepristona como abortivo
- Preguntas clínicas frecuentes acerca del aborto farmacológico OMS
- Prospecto Mifegyne, 200 mg comprimidos de mifepristona, Agencia Española del medicamento, rev. 2008
- Esquema de Mifepristona/Misoprostol, http://www.medicationabortion.com/Spanish/index.html página gestionada por Ibis Reproductive Health
- MedicalAbortionConsortium.org («El aborto con medicamentos, información para mujeres», ICMA [International Consortium for Medical Abortion: consorcio internacional para el aborto médico]).
- Zenit.org («Veintinueve mujeres muertas por la píldora RU486»).
- Mifepristona en MedlinePlus medicinas
-
- Misoprostol (medicamento usado con posterioridad a la administración de Mifepristona)
- Mifepristona como anticonceptivo de emergencia
Categorías:- Anabolizantes
- Anticonceptivos
- Abortivos
Wikimedia foundation. 2010.
